【連載】脳望遠鏡:Biology 5.0で脳に挑む(2)
ガリレオ・ガリレイ(1564-1642)は、初めて望遠鏡を使った天体観測をし、顕微鏡を使って昆虫の複眼を観察しました。ガリレオは、ピサの斜塔の有名な落下実験で知られるように、実験物理学の創始者とされています。ガリレオの父であるヴィンチェンツォ・ガリレイ(1520-1591)は、歴史に残る音楽家として知られていますが、音楽理論に数学的な方法を導入し、息子の志向にも多大な影響を与えたと言われています。顕微鏡で植物を観察することで 「Cell(細胞)」という概念を提唱したロバート・フック(1635-1703)は、弾性に関する法則でも有名です。この時代は、数学、物理学、天文学、化学、バイオ、工学、医学、そして音楽も芸術も密接に「融合」していたのです。
ところがその後、それぞれの分野が分離していきました。20世紀後半の科学研究は、このような分野別の研究が科学研究の典型となってしまいました。そこで近年、分野融合、分野横断(Interdisciplinary)、さらには分野障壁の破壊型(Anti-Disciplinary)ということが、さまざまな場面で強調されるようになってきているのは多くの方が感じていることでしょう。前回説明したBiology5.0では、このマインドセットが決定的に大切になってくると思います。

科学研究の現状では、依然として分野の枠にこだわった研究が盛んであると感じます。これは、研究室、講座、学科、部門、学部、大学、研究所、学会など、いろいろな組織が壁を作っていて、そういう「ディシプリンの壁」を壊せないような仕組みになっているからなのかもしれません。言うまでもありませんが、「Interdisciplinary」とか、「Anti-disciplinary」というのは、そういう壁をなくそうということです。特に、日本の科学研究の現場では、この組織の存在による「ディシプリンの壁」が堅固であるという印象を受けます。さらに、最近のアカデミアの厳しい競争的な環境では、個々の研究者を埋没させるようなタイプの共同研究を阻害しやすくなっているのではないか、という懸念があると思います。
バイオ系でも共同研究というのは、しばしば行われています。ところが実際、分野融合型の共同研究というのはそれほど多くないのです。ほとんどの共同研究というのは、人手が多い方が速く研究が進むという種類のものです。仕事を頑張れば、自分一人でもできるのかもしれないが、他の人にやってもらうという感じです。こういうのは、分野融合ということではありません。
今回は、私が最近体験したひとつの分野融合型の研究について紹介したいと思います。
コネクトームと化学親和説
前回説明したように、コネクトームというのは、 脳神経系のニューロンが作っている神経回路の「まとめてすべて」を意味する概念です。ニューロン同士が接続しているのは、「シナプス」という構造です。シナプスは、神経伝達物質(グルタミン酸、アセチルコリンなど)を放出する顆粒を持つシナプス前部の細胞膜と、神経伝達物質の受容体を持つシナプス後部の細胞膜が接着した構造をしています。接着構造ですから、それをつないでいる接着分子というのが存在していると考えられるわけです。
神経回路では、ニューロン同士の接続の関係が、ちょうど鍵と鍵穴のようになっているために、きちんと神経回路ができあがり、維持されているという説があります。これは半世紀ほど前、ロジャー・スペーリ(1913-1994、1991年ノーベル生理学・医学賞)によって唱えられた説で「化学親和説 Chemoaffinity theory」といいます。直観的にはとてもシンプルで、それぞれのニューロンの表面に鍵、それに接続する別のニューロンに鍵穴があり、両者の形がぴったり同じなので、正しくつながるというアイデアです。この20年ほどの間に、鍵と鍵穴の役割をする分子というのが実際にわかってきています。
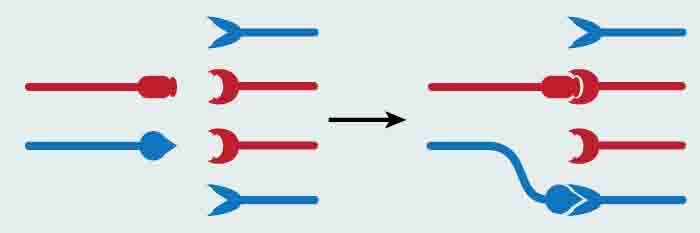
神経回路の相棒をつなぐSidekick
鍵と鍵穴のような化学親和を担う分子に、Sidekick1(Sdk1)およびSidekick2(Sdk2)というよく似た2種類の細胞表面分子があります。Sidekickは「相棒」を意味します。私たちは2002年に、ニワトリの網膜で、異なる種類のニューロンで特異的に発現し、鍵と鍵穴の役割をする細胞表面分子を発見しました(詳細はこちら)。
この分子の性質である鍵と鍵穴の化学親和の関係は明確で、Sdk1はSdk1と、Sdk2はSdk2とのみ結合し、Sdk1とSdk2とは結合しないホモフィリックな性質を持ちます。つまり、鍵と鍵穴が同じ分子になっているということです。したがって、2つのニューロンが同じSdkを発現していれば,神経突起どうしがホモフィリックな結合を起こし、回路の接続にいたると考えられます。
私たちは2015年に、マウスの網膜で、網膜のニューロン「W3B」とその神経結合のパートナーであるニューロン「VG3」において、Sdk2が発現していることを報告しました。Sdk2がこの2種類のニューロンが作っている神経回路を規定しているということになります。さらに、Sdk2遺伝子を発現できなくなるようにしたマウスでは、2種類のニューロン間の結合に障害が起こることを、光遺伝学の手法などにより示しました。この分子の研究については、私たちも未だBiology3.0の世界を徘徊していますが、将来的にはBiology5.0の世界になるようにしたいと考え、現在も研究を続けております。
分野融合アプローチでわかった化学親和力を高める新しいメカニズム
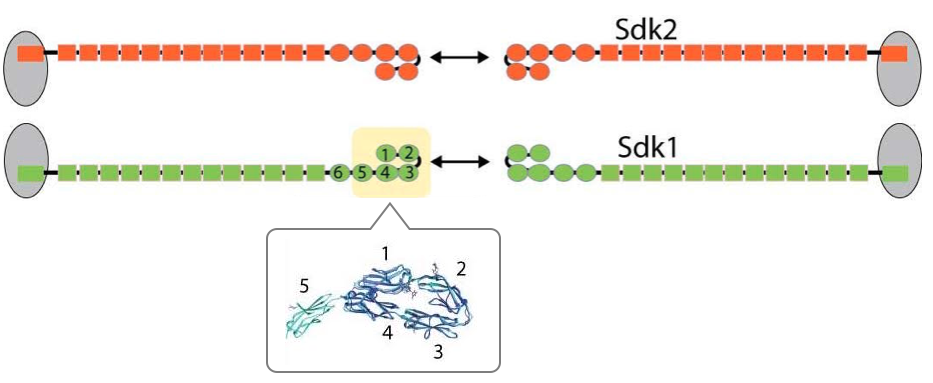
最近、ニューヨークのコロンビア大学の構造生物学者との共同研究で、細胞表面分子の頭側にある「馬蹄(うまのひづめ)」の形をした部分の立体構造を報告しました。上図で番号を付けた6つの楕円形の構造が丸まることで、馬蹄形になります。馬蹄形の部分は、血液中にある抗体分子である免疫グロブリンと構造がよく似ているので、免疫グロブリンドメイン(Immunoglobulin, Ig)ドメインと呼ばれています。
私たちは、その部分のSdk1とSdk2の結晶構造を解くことに成功し、その構造からホモフィリックな結合がどのように生じるのかということを推測しました。この研究は、共同研究者であるコロンビア大学の構造生物学者(Kerry Goodman博士、Barry Honig博士、Larry Shapiro博士)がX線結晶構造解析を、私が細胞を使った実験を担当しました。私自身、学部生時代に生化学の研究をやっていましたので、タンパク質の結晶作製にも少し馴染みはありましたが、X線結晶構造解析の経験は全くありませんので、本研究は全く異なる分野が融合した研究の典型であると思います。
ホモフィリックな結合をするIgドメインを持った認識分子は数多く知られていますが、驚いたことに、Sdkの構造から推定されたホモフィリックな分子間相互作用は、これまで解明されてきた類似分子の様相とかなり違っていました。また、タンパク質の構造の中で、どのアミノ酸残基がこのホモフィリックな親和性に大切かというのもわかりました。その特定のアミノ酸残基を別のアミノ酸に変異すると、分子全体を細胞に発現させた時に観察される細胞接着活性も消失しました。興味深いことに、この活性を失った変異分子は、異なる細胞間での細胞接着をしなくなるだけでなく、ひとつの細胞に発現させた場合も、正常なものとは違う挙動を示すことがわかりました。つまり、下図のように、本来、細胞接着や認識のために異なる細胞表面に発現した場合に起こる分子間相互作用(trans相互作用=細胞接着)が、同じ細胞表面上でも起っているということです(cis相互作用)。
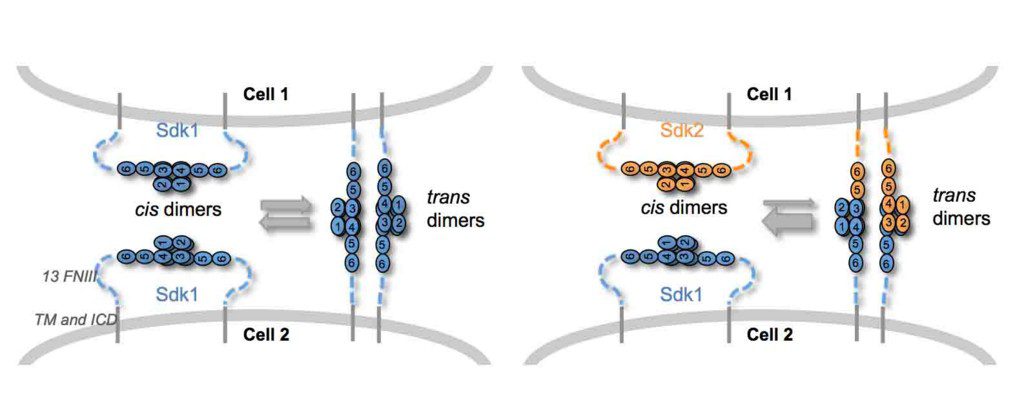
つまり、Sdk1の場合、cis相互作用とtrans相互作用を同じ構造を使って行っているようです。その結果、trans相互作用(細胞接着)が起っていない時には、同じ細胞表面上でcis相互作用していることで、かすかに見られるSdk2との結合を防止していると考えられます。このようにして、cisとtransの相互作用が細胞表面上で競合的な関係になっていることで、シナプスができる時の鍵と鍵穴の特異性を更に強めているのではないか、という新しいモデルを提唱しています。
参考文献
- シナプス接着分子Sdk2は網膜において物体の動きを検出する神経回路の形成に機能する(2015年)山形方人 ライフサイエンス新着論文レビュー
- Sanes JR, Yamagata M. (2009) Annu Rev Cell Dev Biol. 25:161-195. Many paths to synaptic specificity. Goodman KM, Yamagata M, Jin X, Mannepalli S, Katsamba PS, Ahlsén G, Sergeeva AP, Honig B,Sanes JR, Shapiro L.(2016) Elife. 2016 Sep 19;5. pii: e19058. Molecular basis of sidekick-mediated cell-cell adhesion and specificity.
この記事を書いた人
- Harvard University。名古屋大学理学研究科化学専攻で、理学博士。 高校時代は地学部で天文学に関心がありましたが、生化学に関心を持ち、 糖鎖やタンパク質の研究をしました。その後、細胞生物学、発生生物学に興味を持ち、現在は、脳神経回路の発生と機能の研究に関心があります。尖った人材になって、尖った人財を育てたいと思います。
この投稿者の最近の記事
 研究成果2016.12.12【連載】脳望遠鏡:Biology 5.0で脳に挑む(4)
研究成果2016.12.12【連載】脳望遠鏡:Biology 5.0で脳に挑む(4) 研究成果2016.11.22【連載】脳望遠鏡:Biology 5.0で脳に挑む(3)
研究成果2016.11.22【連載】脳望遠鏡:Biology 5.0で脳に挑む(3) 研究成果2016.11.04【連載】脳望遠鏡:Biology 5.0で脳に挑む(2)
研究成果2016.11.04【連載】脳望遠鏡:Biology 5.0で脳に挑む(2) 研究成果2016.10.21【連載】脳望遠鏡:Biology 5.0で脳に挑む(1)
研究成果2016.10.21【連載】脳望遠鏡:Biology 5.0で脳に挑む(1)



