FTLD、ALS、PSP、CBDを含む幅広い神経変性疾患「FTLD疾患スペクトラム」に共通する分子メカニズム
神経変性疾患の分類
年齢を重ねてから発症して、緩やかに進行していく中枢神経系の疾患を「神経変性疾患」と総称します。これらには、アルツハイマー病などの認知症や、パーキンソン病、筋萎縮性側索硬化症(ALS)といった疾患が含まれます。こうした神経変性疾患では疾患部位の神経細胞が最終的に死に至り、神経機能を果たせなくなることが病気の本体であるのですが、神経変性疾患のほとんどを占める(遺伝が明らかでない)孤発例での発症メカニズムはほとんどが不明であり、そのために根本治療法が存在しません。
一方で、多くの研究結果の積み重ねにより孤発性の神経変性疾患では、封入体と呼ばれる異常タンパク質の蓄積が疾患の分類を行ううえでもっとも重要な手がかりであることがわかっています。たとえば、アルツハイマー病ではアミロイドβの細胞外への蓄積(老人斑)やリン酸化タウの神経細胞内への蓄積(神経原線維変化)が古くから病理学的な特徴として知られていますし、パーキンソン病におけるαシヌクレインの蓄積やALSにおけるTDP-43やFUSの蓄積なども、疾患分類の根本をなしています。
ただ、疾患の概念というのは人間が勝手に線引したものともいえます。事実、多くの神経変性疾患は明確に区分できるものではなく、グラデーションを形成していると考えられています。たとえば、前頭側頭葉変性症(FTLD)は人格の変化や情動の障害が前景に生じることが特徴の認知症ですが、タウタンパク質の蓄積が認められる症例があり、タウオパチー(異常タウタンパク質が蓄積する特徴を持つ疾患の総称)のひとつと考えられています。一方でFTLDの一部には、運動ニューロン病である筋萎縮性側索硬化症(ALS)と遺伝的、臨床的、病理的な共通性を持つ症例が存在し、ALSと同一の疾患スペクトラムを形成しているとも考えられています。

FTLD類縁疾患の新たな指標:FUS/SFPQとタウアイソフォーム
FTLDは若年性認知症のなかでは2割近くの割合を示すともいわれていますが、高度の性格変化や社会性の喪失、ときには軽犯罪などを認めるために、とりわけ家庭や職場などで社会的な問題を引き起こすことがしばしばあり、その分子的メカニズムの解明や治療法の開発は喫緊の課題となっています。
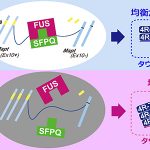
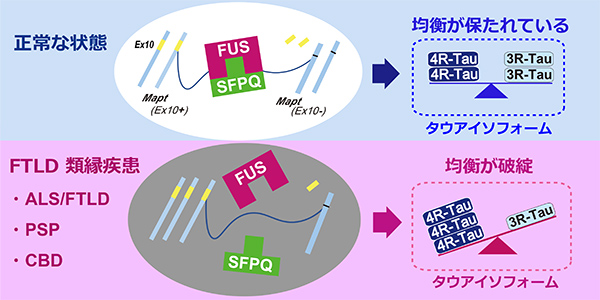
私たちはこれまでにRNA結合タンパク質であるFUSが核内で高分子複合体を形成し、別のRNA結合タンパク質であるSFPQと結合すること、FUSとSFPQはどちらも選択的スプライシングを通じてタウアイソフォームのバランス変化を制御すること、FUSおよびSFPQの機能喪失マウスモデルは情動の異常を中心とするFTLD様の高次機能障害を呈することなどを報告しており、以前にこの場でもご紹介させていただきました(参考:認知症の一種「前頭側頭葉変性症」の発症メカニズム – なぜ神経変性疾患の治療は困難なのか )。今回、この知見を発展させる形で、剖検脳を用いた病理学的解析をFTLDとその類縁疾患に関して行いました。
海馬および前頭葉の神経細胞の核内におけるFUSとSFPQの微小局在と結合性について疾患横断的に病理組織学的、生化学的手法を用いて調べたところ、家族性および孤発性の筋萎縮性側索硬化症(ALS)、前頭側頭葉変性症(FTLD)、進行性核上性麻痺(PSP)、大脳皮質基底核変性症(CBD)といった広義FTLD疾患スペクトラムにおいてFUSとSFPQの核内での局在異常を、前頭葉、海馬の神経細胞で認めました。また、FUSとSFPQが制御するMAPT遺伝子の選択的スプライシングの産生物であるタウアイソフォームのバランス異常を認めました。
一方で、アルツハイマー病およびピック病ではこうした変化を認めませんでした。また、これまでの病理学的な指標である封入体(FUS、TDP-43およびリン酸化タウ)との相関については、統計学的に有意な関連性を認めませんでした。
これまでの封入体を基準にした病理学的な解析では、ALSと臨床的・遺伝学的・病理学的に連続するFTLDのグループとタウに関連するFTLDのグループに共通する分子メカニズムは明らかでありませんでした。
また、FUSが関連するALS/FTLDについては、免疫染色による封入体の可視化が技術的に難しかったこともあり、実際よりも低く見積もられていた可能性があります。最近の報告では、FUS凝集体がTDP-43型の孤発性ALS患者iPSC由来神経細胞においても認められることなど、これまで考えられていたよりも広範な病態にFUSが関与していることがわかりつつあり、今回の研究結果もそういった可能性を強く支持します。
またPSPやCBDといった疾患はタウのなかでも4Rタウアイソフォームが優位に蓄積することが知られており、私たちが見出したタウアイソフォームのmRNAバランス異常が原因のひとつであることが想定されます。このように、FTLDのみならずALS、PSP、CBDも含む幅広い「FTLD疾患スペクトラム」における共通の分子メカニズムとしてFUS/SFPQの会合異常とタウアイソフォーム変化が、潜在的メカニズムとして存在することを示唆されました。
認知症根本治療法開発へ向けて
神経変性疾患全般にあてはまることですが、疾患を根本から治すことができる治療薬は存在しませんし、その開発も険しいものがあります。たとえば、アルツハイマー病の新薬候補薬剤の臨床試験は9割以上が失敗に終わっています。米国研究製薬工業協会によると、1998年から2017年までに承認された新薬はわずかに4薬で、失敗した臨床試験の数は146とされます。これには、神経変性疾患のメカニズムそのものの複雑さに加え、有効なバイオマーカーが存在しないことや、疾患のheterogeneity(不均一さ)も要因と思われます。
今回、私たちが見出したメカニズムは、幅広い「FTLD疾患スペクトラム」に共通と考えられますので、これをもとにした治療法は疾患の不均一さをある程度乗り越えられるかもしれません。また、これまでに私たちはマウスモデルを使った研究を通じて、タウアイソフォームの変化を正常に近づけるような介入実験によってFTLDのフェノタイプが回復することを見出しています。このことからFUSとSFPQの機能喪失とそれに伴うタウアイソフォームの変化を標的とした治療が、神経変性疾患に広く応用できる可能性が考えられ、今後の展開として核酸医薬などによる根本治療法の開発が期待されます。
剖検組織を用いたこうした研究は、亡くなられた患者様とご家族のご同意いただいた篤志のうえで成り立っています。この場を借りて心より深謝申し上げます。
参考文献
Aberrant interaction between FUS and SFPQ in neurons in a wide range of FTLD spectrum diseases. Ishigaki S, Riku Y, Fujioka Y, Endo K, Iwade N, Kawai K, Ishibashi M, Yokoi S, Katsuno M, Watanabe H, Mori K, Akagi A, Yokota O, Terada S, Kawakami I, Suzuki N, Warita H, Aoki M, Yoshida M, Sobue G. Brain. 2020 Aug 8:awaa196. doi: 10.1093/brain/awaa196. Online ahead of print.
この記事を書いた人

-
石垣診祐
名古屋大学大学院医学系研究科特任准教授。神経変性疾患のメカニズム解明、バイオマーカー開発、治療法開発の研究をしています。独自性や多様性をもとに、新たな研究領域を切り開きながら難病の研究に貢献していきたいと考えています。
陸雄一
愛知医科大学加齢医科学研究所
祖父江元
愛知医科大学