認知症の一種「前頭側頭葉変性症」の発症メカニズム – なぜ神経変性疾患の治療は困難なのか
これまでにメディアで「社会的地位にあった人が痴漢で逮捕」とか「立派な家がいつの間にかゴミ屋敷に」などのニュースに接したことがある方は多いかと思います。でも、こうした事件のなかには前頭側頭葉変性症(FTLD)の初期症状だった人がもしかするといるのかもしれない、ということを知っている方は少ないのではないでしょうか。
前頭側頭葉変性症(FTLD)とは
FTLDは前頭側頭型認知症(FTD)とほぼ同義と考えられており、アルツハイマー病などと比べると少ないですが、若年性認知症の約2割を占めると考えられています。人格の変化や情動の障害が前景に生じることが特徴で、万引きや痴漢など反社会的行為を起こしてしまうことがあることから、社会的にも問題になってきています。2014年には大阪高裁で窃盗累犯(万引き常習)を問われた女性がこの疾患であることがわかったために猶予認定されたという事例があり、司法関係のほうでも注目をされるようになってきています。しかし残念なことにFTLDの疾患概念そのものがわかりにくいことなどから、一般の人々にはもちろん医療関係者にさえ、しっかりとは認知されていない状況です。このため相当数の患者さんがFTLDだと気づかれないまま、家族や周囲を巻き込んで苦境に陥っている可能性があります。
FTLDはアルツハイマー病やパーキンソン病をはじめとする神経変性疾患のひとつであり、病名の由来のとおり前頭葉と側頭葉での神経脱落を病理学的な特徴とします。アルツハイマー病では病理学的にアミロイドβとタウタンパク質の蓄積が大きな特徴ですが、FTLDにおいてもタウタンパク質の蓄積が認められる症例があり、タウオパチー(異常タウタンパク質が蓄積する特徴を持つ疾患の総称)のひとつと考えられています。一方でFTLDの一部には、運動ニューロン病である筋萎縮性側索硬化症(ALS)と遺伝的、臨床的、病理的な共通性を持つ症例が存在し、ALSと同一の疾患スペクトラムを形成しているとも考えられています。少しわかりにくいかと思いますが、これはほとんどの孤発性(家族歴のない)の神経変性疾患の分類には明確な境界が実際には存在せず、それぞれが下の図のようにグラデーションを形成しているというように考えるとわかりやすいかと思います。

タウオパチーとしてのFTLDではリン酸化タウの蓄積が、ALSに近いFTLDではTDP-43、FUSをはじめとするRNA結合タンパク質の蓄積が病理学的な特徴です。これらの異常蓄積を特徴とする分子の生理的な機能については不明な点が多く、たとえばタウは神経細胞内で微小管に結合することは知られていますが、実際にどのような神経機能を私たちの神経組織で生理的に有しているのかはわかっていません。同じように、RNA結合タンパク質であるTDP-43やFUSが核内で転写や選択的スプライシングに関与していることは明らかになっていますが、神経機能に具体的に関与している詳細についてはほとんどわかっていません。
FTLDの発症メカニズム
私たちは、FUSが神経細胞の核内で別のRNA結合タンパク質であるSFPQと結合して、複合体を形成することで選択的スプライシングを制御し、結果としてタウタンパク質の種類(アイソフォーム)のバランスを担っていることを明らかにしました。さらに、FUSやSFPQの機能喪失マウスモデルでは、このタウタンパク質の種類(アイソフォーム)のバランスが崩れることで、情動の異常などFTLDに類似する高次機能の障害が起きることを明らかにしました。
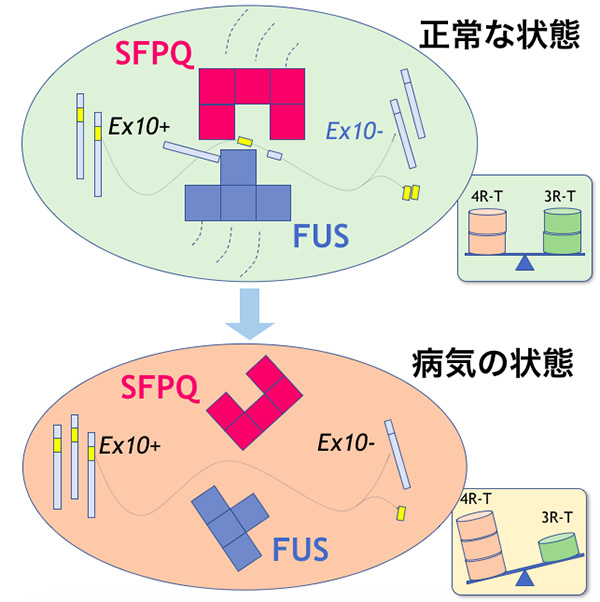
このバランスを元に戻すことで高次機能障害が回復したことから、タウタンパク質の種類(アイソフォーム)のバランス異常がFTLDをはじめとする4R タウ優位の病理像を特徴とする進行性核上性麻痺(PSP)、大脳皮質変性症(CBD)などタウオパチーと呼ばれる認知症の早期病態を引き起こしている可能性が示唆され、この早期の病態をターゲットにした根本治療の開発を今後行っていきたいと考えています。
なぜ神経変性疾患の治療は困難を極めているのか
ただ、もしかすると「それって、よくある研究者の希望的観測なのでは?」と思われるかもしれません。実際のところFTLDはもちろん、アルツハイマー病やALSなどの根本治療薬は未だに開発されていません。それどころか近年の臨床試験は95%以上が失敗に終わっています。ですから、なぜ神経変性疾患の治療は困難を極めているのかを考えていく必要があります。下の図のように神経変性疾患を含めた慢性疾患では実際に症状が表れる以前より水面下で病気は進行してきており、シグモイド曲線のような経過をたどるものと考えられています。
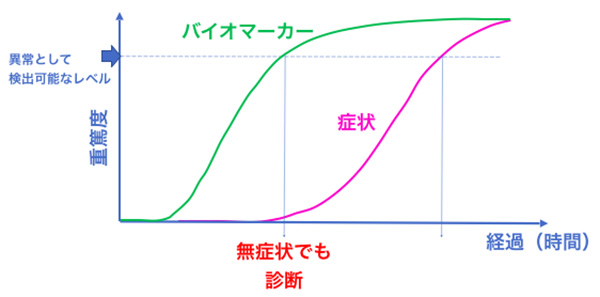
図の中にあるバイオマーカーというのは臨床症状が未発症の時期に検査などによって疾患を診断することができる指標のことです。たとえば糖尿病(2型)における血糖値、高血圧における血圧値はバイオマーカーに相当します。バイオマーカーが鋭敏で有用であればあるほど、その疾患は臨床症状が出る前にコントロールできて症状を押さえ込むことができます。では、認知症などの神経変性疾患ではどうかというと、残念ながら今のところバイオマーカーという便利な指標は存在していません。神経変性疾患に有効な治療法がほとんど存在しないのは、バイオマーカーがないことが理由と言ってもいいでしょう。今回の私たちの研究から、疾患関連タンパク質の本来の生理的な機能が、病気のメカニズムを考えるうえで重要な役割を担っているのではないかと推測されました。こうした生理的な機能を明らかにしていくことは根本治療法の開発だけでなく、バイオマーカーを見つけるという観点からも重要であり、疾患研究における基礎的な研究がとても大切であることを再認識する必要があるかと思います。
引用文献
Ishigaki S, Fujioka Y, Okada Y, Riku Y, Udagawa T, Honda D, Yokoi S, Endo K, Ikenaka K, Takagi S, Iguchi Y,Sahara N, Takashima A, Okano H, Yoshida M, Warita H, Aoki M, Watanabe H, Okado H, Katsuno M, Sobue G.(2017). Altered tau isoform ratio caused by loss of FUS and SFPQ function leads to FTLD-like phenotypes.,Cell Reports 18(5),1118–1131.
この記事を書いた人

- 2002年 名古屋大学大学院医学系研究科後期博士課程修了。マサチューセッツ大学医学部研究員を経て、現在は名古屋大学大学院医学系研究科難治性神経疾患治療学助教。神経変性疾患のメカニズム解明に従事しています。競争の激しい世界ですが、独自の視点と切り口でニッチを攻めることで医学、神経科学の進歩に貢献したいと考えています。




