AIによる緑内障の自動診断 – 未来型の個別化医療を目指して
【関連記事】緑内障による失明を食い止めたい – 個別化医療への挑戦
未来型医療とは?- 東北大学が目指す個別化医療
最近、IoT(Internet of Things)やビッグデータ、人工知能(Artificial Intelligence; AI)、AIロボットなどが注目を浴びています。質の高い臨床データをAIが解析することにより、今まで数値化することができず、医師が勘や経験に頼っている事例においても法則性などが発見される可能性があります。私も、一臨床医としてAIに期待しています。AIによる診断や治療のアルゴリズムが開発されることによって、医療の標準化がもたらされ、日本全国何処でも格差のない医療が展開されることが期待されます。
東北大学は指定国立大学の認定をうけ、ライフサイエンス領域では未来型医療創成センターが設立されました。「未来型医療」では、病気の個人差に影響しうる遺伝や免疫、抗酸化力、炎症、代謝などの体質を理解し、病気のなりやすさや予後、薬の効果、副作用などを予測しながら、個人に最適な予防や治療を行うことを目指しています。
疾患を予防することは最良の医療であります。早期に積極的な治療を行えば予後が改善される疾患に対しては、治療をしっかりと行い、一方、治療を強化しなくても予後の良い疾患に対しては、相応の治療を行う。それが、限られた医療費の適正使用にもつながります。資源が限られた日本にとって、効率的な医療機器や医薬品の開発は重要な産業分野です。
東北大学における未来型医療創成センターは、15万人の健常人のコホートデータを有する東北メディカルメガバンクと、患者を対象とした東北大学病院バイオバンクである個別化医療センターが両輪となって研究を進めています。さまざまな専門分野を持つ研究者が協力し、2030年には個別化予防・個別化医療を実現することを目標としています。
ヒトの遺伝子の0.1%は、個人によって異なる(遺伝子多型)ことが知られており、その違いが体質の個人差に関与すると考えられています。東北メディカルメガバンクでは、日本人の遺伝子多型を、血液から安価で大量に調べることが可能なジャポニカアレイという検査ツールを開発しました。我々もこのアレイを用いて緑内障になりやすい遺伝子の体質を研究しています。生涯、遺伝子は変化しないので、今後は、数万円で遺伝子多型の特徴から自分の体質を理解し、かかりやすい病気を意識して予防する時代も、そう遠い未来の話ではないかもしれません。
「未来型医療」を成功させるためには、医師の手だけでは不十分で、より多分野のスタッフが、ライフサイエンスを自身の研究の応用領域として発展させていくことが重要だと考えています。創薬開発において主役となる薬学、医療機器や医療ロボットの開発に重要な工学、ビッグデータやAI研究は情報科学など、理系の先生方はもちろんのこと、文系の先生方にとっても、経済的視点で病気の社会的損失を評価する方法や、医療における日本人の特性を生かしたコミュニケーションの手法、終末期を意識した病気重症度の考え方など、あらゆる研究領域において、健康産業や医療分野を足場に、その研究成果を社会に還元できると考えられます。
東北大学は未来型医療創造卓越大学院プログラムを今年度から開始しました。データ(Data)と技術(Technology)を駆使して未来の社会(Society)の課題解決に寄与する人材を育成しています。文理共学、産官学連携、国際連携をキーワードに、世界に先んじて超高齢社会となりつつある東北地方から未来型の技術や個別化医療を開発し、未来型医療として世界へ展開することが目標です。
今の日本は、これまでの枠組みにとらわれることなく、新たな領域へチャレンジして開拓していく必要があります。そういった新しいことへの高い適応力は若者の強みです。是非、産官学連携や文理共学に興味のある方は参画していただけることを期待しています。
人工知能は緑内障の診療に向いている
私は眼科医であり、東北大学眼科は「失明ゼロを目指す」というビジョンをもって未来型医療創成に向けた研究活動を行っています。緑内障は40歳以上の5%、70歳以上では11%が罹患し、加齢により発症頻度が高くなる眼の病気です。
現在、緑内障は中途失明原因の第1位であり、超高齢社会に突入した本邦では、緑内障による失明患者が毎年増加しています。そこで、我々は明るい超高齢社会の実現のために、緑内障患者を皆失明させないために、新たな治療薬や検査機器の開発まで含めた「緑内障撲滅プロジェクト」に取り組んでいます。(参考記事:『緑内障による失明を食い止めたい – 個別化医療への挑戦』)
人工知能による研究を緑内障に用いるのには、いくつかの理由があります。
- 慢性の経過をたどり、早期発見が重要である
- 多因子疾患である
- 画像診断が主な検査方法である
1. 緑内障の進行は通常ゆっくりですが、慢性の経過をたどります。そのため、10年かけて視野異常の範囲がゆっくり拡大して高度な視野障害や視力低下に至ります。緑内障は、進行すると車の運転や日常生活に支障をきたすなど、生活の質を著しく損なう眼疾患です。正常の老化現象によっても網膜神経節細胞は年々減少しますが、細胞には余裕があるため、半分以上の網膜神経節細胞が減少して初めて自覚症状を有します。そのため、緑内障には「予防」や「早期発見・早期治療」によって視野異常の進行を遅らせることが特に重要です。この進行様式はアルツハイマー病とも大変よく似ており、2つの病気を合併する患者さんも多く見られます。
2. 緑内障の主な治療は眼圧を下降させる点眼薬となっています。しかし、緑内障による失明患者が年々増えているという事実は、更なる新規の治療が必要であることを物語っています。緑内障は、近視、低血圧、冷え性、睡眠時無呼吸症候群などとよく合併することが知られ、「多因子疾患」であると考えられています。現在、全医療のなかで根治できていない病気の多くが多因子疾患であり、その分野に多大な医療費が投入されています。今後は、多因子疾患の因子ごとに患者をグループに分け(層別化)、その原因に適切な治療を開発し施すことが理想的です。
3. 緑内障の診断は、従来から使われてきたカラー眼底画像や、光干渉断層計(OCT)画像に対する読影と視野検査による主観的判断で行われます。現在は眼科医が減少し、地方では眼科医不在の地域が増えてきています。高齢者に緑内障の有病率が高いことを考えると、過疎地域こそ眼科診療が必要な地域です。健診の眼底写真で緑内障を指摘されることが多く、緑内障発見において画像診断は極めて重要な地位を占めています。
こうした背景から、緑内障は人工知能を用いた研究に向いています。今後は、ネットワーク環境を応用した遠隔診療や人工知能による自動診断の補助を受けながら、病態に即した適切な層別化と治療体系を組み上げていく必要があります。
人工知能による緑内障の自動診断
我々は、理化学研究所(理研)光量子工学研究センター眼疾患クラウド診断融合連携研究チームとの共同研究で、眼底検査装置からのマルチモダリティ画像情報(複数の異なる装置で撮影した画像データ)を用いて、視神経乳頭形状から緑内障を4タイプに分類する方法や、緑内障の自動診断が可能な機械学習モデルを構築しました。
これまで機械学習による眼科疾患検出は、大量の眼底写真から糖尿病を診断する自動診断システムがFDA(アメリカ食品医薬品局)で認可されるなど、世界的な大きな進展があります。しかしながら、緑内障は視神経乳頭陥凹という3次元の変化を来す疾患で、2次元のカラー眼底写真のみで自動診断するのは難しいことが知られていました。
そこで我々は、眼底写真に加え、深さ方向の3次元データを有する光干渉断層計(OCT)の情報を機械学習に使用し、マルチモダリティ画像情報を用いた機械学習が緑内障の診断に貢献することを示しました。
以前に我々は、緑内障の視神経を分類するために、カナダのグループNicolelaらが提唱している、臨床背景を異にする4つの視神経乳頭形状の分類を機械学習により分類するアルゴリズムを報告しました。この分類方法は、緑内障病態の層別化として重要であり、グループ間で眼圧下降治療の効果、進行の速さ、視力低下を伴いやすいなど、臨床的にも重要な層別化が、全国のどの病院でも標準化できることを証明しました。
今回我々は、緑内障の補助診断において、眼底写真とOCTの視神経乳頭部と黄斑部を撮影し、神経の厚みを定量化したカラーマップを含めたマルチモダリティ画像情報を用いて、転移学習の手法によって緑内障の自動診断を行う機械学習モデルの構築を試みました。
緑内障専門医による確定診断付きの緑内障208眼と健常149眼を対象として、すべての眼からの、1) 視神経乳頭部のカラー眼底写真(RGB画像中のGreen成分のみ)、2) 3次元OCTデータから得られる視神経乳頭神経線維層層厚マップ、3) 視神経乳頭神経線維層デビエーションマップ、4) 黄斑部の神経節細胞複合体層厚マップ、5) 黄斑部の神経節細胞複合体デビエーションマップを抽出しました。デビエーションマップは、正常眼データベースから算出した層厚マップの平均画像との差分画像です。
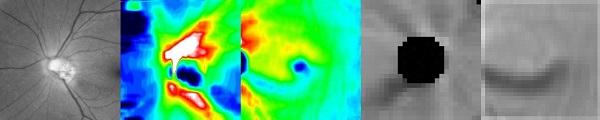
左から右の順で、1) カラー眼底のグリーンチャンネル、2) 視神経乳頭神経線維層層厚マップ、3) 視神経乳頭神経線維層デビエーションマップ、4) 黄斑部神経節細胞複合体層厚マップ、5) 黄斑部神経節細胞複合体デビエーションマップ
次に、上記5種類の画像データセットについて、公開された訓練済のCNN(畳み込みニューラルネットワーク: Convolutional Neural Network)モデルの1種であるVGG19モデル(転移学習)を用いて、それぞれのVGG19モデルを構築しました。
CNNでは一般的に特徴量抽出部と分類部があり、トレーニングによって両者ともに自動的に学習されます。本研究では、それらのVGG19モデルの特徴抽出部から正常と緑内障を分類するのに必要な特徴量を抽出した後、ランダムフォレストで学習させました。
構築した機械学習モデルの性能を調べるために、10-分割交差検証法により各種画像の組み合わせを検証した結果、最高性能として0.963のAUC(Area Under the Curve)を示す結果を得ることができました。AUCは機械学習モデルの分類性能を評価するのによく使わる指標のひとつで、値が1に近いほど判別性能が高いことを示します。
本成果は、各症例に対して提案した機械学習モデルにより、緑内障の確信度を提示することで、健診やかかりつけ医などで、緑内障の早期発見につながると期待できます。
最後に
東北大学は大震災からの復興をアカデミックなアプローチによって実現することを期待されている大学です。医療の分野には、まだまだ手がつけられていないことや課題が多くあるのが現状です。
東北大学の眼科では、社会的に重要性の高い緑内障に対し、未来型医療創成センターや産官学連携を介して、緑内障撲滅のためのさまざまなアプローチで未来型医療を実現し、健診・検査・治療・リハビリまですべてを未来型に変え、細部にまで英知の詰まった個別化診療を確立していきたいと思っています。
東北大学の門戸開放の精神に基づいて、医師以外のさまざまな背景を持った研究者や、関心のある学生さんなどと共に、多くの仲間と未来型医療創成に一緒に取り組んでいけることを期待しています。
参考文献
- Omodaka K, An G, Tsuda S, Shiga Y, Takada N, Kikawa T, Takahashi H, Yokota H, Akiba M, Nakazawa T. “Classification of optic disc shape in glaucoma using machine learning based on quantified ocular parameters” PLoS One. 2017 Dec 19;12(12):e0190012.
- An G, Omodaka K, Hashimoto K, Tsuda S, Shiga Y, Takada N, Kikawa T, Yokota H, Akiba M, Nakazawa T. “Glaucoma Diagnosis with Machine Learning Based on Optical Coherence Tomography and Color Fundus Images” J Healthc Eng. 2019 Feb 18;2019:4061313.
- An G, Omodaka K, Tsuda S, Shiga Y, Takada N, Kikawa T, Nakazawa T, Yokota H, Akiba M. “Comparison of Machine-Learning Classification Models for Glaucoma Management” J Healthc Eng. 2018 Jun 19;2018:6874765.
この記事を書いた人
- 1995年東北大学医学部卒業、2002年東北大学大学院医学系研究科博士課修了。医学博士、眼科専門医。米国ハーバード大学眼耳鼻科病院で3年間の博士研究員を経て、2007年東北大学病院眼科講師となる。2011年3月東日本大震災を経験し、被災地における眼科診療や整備の精力的な活動を行った。同年9月東北大学医学系研究科眼科教授となる。「自分にしてほしい最善の医療を低コストで」をテーマに個別化医療の開発に取り組んでいる。本教室の基礎研究部門は常に多職種にオープンであり、工学、薬学、農学のPhDが研究者として仲間となっている。また、眼科領域でも最先端の技術の恩恵に預かれるように、積極的な共同研究を展開し、常に募集している。「失明ゼロ」を目指し、日本から世界へ発信するべく取り組んでいる。
この投稿者の最近の記事
 研究成果2019年5月15日AIによる緑内障の自動診断 – 未来型の個別化医療を目指して
研究成果2019年5月15日AIによる緑内障の自動診断 – 未来型の個別化医療を目指して 研究成果2016年10月5日緑内障による失明を食い止めたい – 個別化医療への挑戦
研究成果2016年10月5日緑内障による失明を食い止めたい – 個別化医療への挑戦



