長期記憶に不可欠な分子RNG105 – ニューロンでのタンパク質合成と長期記憶形成をつなぐ仕組み
私たちが日々過ごすなかで、数分も経たずに忘れ去ってしまう物事はたくさんあります。一方で、数時間から長いときには数十年間にわたって記憶している物事もあります。この「短期記憶」と「長期記憶」の違いは、物事を覚えた際に、脳内の神経細胞(ニューロン)でタンパク質の合成が起こらなかったか、あるいは起こったかの違いによると考えられています。
つまり、長期記憶の形成には、ニューロンでのタンパク質合成が必要です。しかし、数万種類も存在するタンパク質のうち、どの種類が合成されるのか、また、どのような仕組みでタンパク質合成が起こるのかについては、これまであまりよくわかっていませんでした。私たちの研究グループは、RNG105と呼ばれる分子(これもタンパク質の一種です)が、長期記憶の形成に不可欠であることを発見し、さらに、RNG105が関わるタンパク質合成の仕組みを明らかにしました。
ニューロンで起こる「局所的」なタンパク質合成
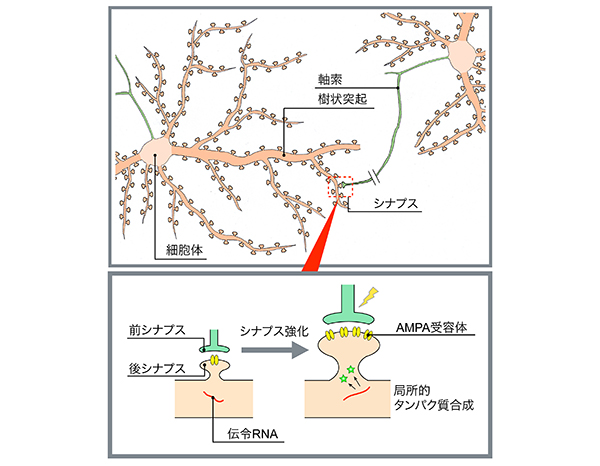
ニューロンは突起を伸ばし、他のニューロンの突起とつながることでニューロンネットワークを形成しています。このつなぎ目は「シナプス」と呼ばれています。私たちが物事を覚える際には、ニューロンがシナプスを介して他のニューロンへ信号を送り、その信号を受け取ったニューロンがさらに次のニューロンへシナプスを介して信号を送るという、信号の伝達リレーが起こります。
物事を記憶して思い出すときには、再度同じニューロンネットワークで信号伝達が起こります。ですから、長期記憶のためには、このネットワークのつなぎ目であるシナプスが切断されないように、強化して維持しておく必要があります。その強化のために働くタンパク質は、数十種類以上あると考えられています。信号伝達の際にシナプス付近でそれらタンパク質を局所的に合成することが、長期記憶の形成に必要なのではないかと考えられていますが、その関連性は明らかではありませんでした。
タンパク質を合成するためには、その材料が必要で、特に、タンパク質の設計図となる伝令RNAが必要です。シナプスで局所的にタンパク質を合成するためには、シナプスの近くに伝令RNAを配置させておく必要があるわけです。RNG105は伝令RNAに結合する分子であり、シナプスの近くまで移動する能力を持つという私たちのこれまでの研究結果から、RNG105が長期記憶形成に関わるタンパク質合成に重要な役割を担う候補分子ではないかと予測しました。
RNG105欠損マウスでは長期記憶が低下
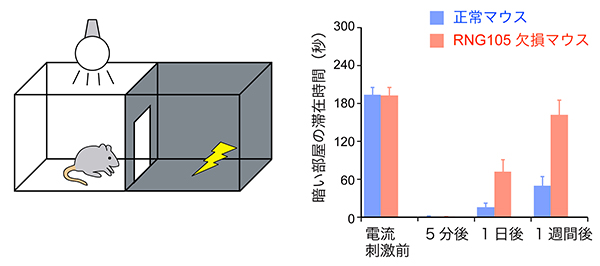
RNG105が長期記憶の形成に必要かどうかを調べるために、遺伝子改変によってRNG105を欠損したマウスを作製し、5種類の学習・記憶テストを行いました。その結果、すべてのテストでRNG105欠損マウスの長期記憶が著しく低下しているという結果を得ました。
その一例が、条件付け文脈学習テストです。このテストでは、明るい部屋と暗い部屋とを自由に行き来できる装置を用います。通常、マウスは暗い場所を好み、そこに長く滞在します。しかし、暗い部屋に入った際に弱い電流を経験すると、マウスは嫌悪の経験を記憶し、その後は電流が流れなくても暗い部屋の滞在時間が減少します。この暗い部屋の滞在時間を計測した結果、RNG105欠損マウスは5分間の短期記憶は正常にできるのに対し、1日から1週間に渡る長期記憶の形成は正常マウスに比べて著しく障害されていることが明らかになりました。
RNG105欠損マウスのニューロンではシナプス強化が上手くいかない
シナプス強化を評価する方法のひとつとして、人為的な刺激によってシナプスの信号伝達を起こし、その際に信号の受け取り側のシナプス(後シナプス)が肥大化する現象を顕微鏡で観察する方法があります。この方法を用いて、RNG105の欠損がシナプス強化に与える影響を調べました。正常ニューロンでは刺激により後シナプスが肥大し、そのサイズは刺激後1時間経っても維持されました。一方、RNG105欠損ニューロンでは刺激により後シナプスは一度肥大したものの、時間経過とともに次第に縮小しました。
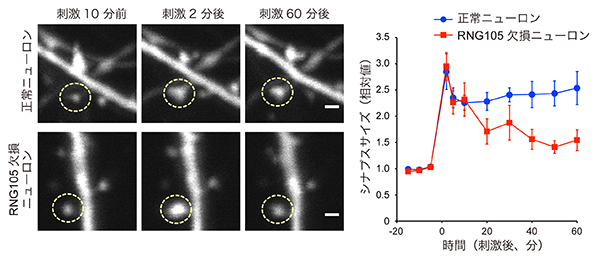
別の評価法として、後シナプス表面のAMPA受容体の量を測定する方法があります。AMPA受容体とは、シナプス信号伝達に中心的役割を果たす分子です。AMPA受容体を検出する抗体染色法という手法でその量を測定した結果、正常ニューロンに比べてRNG105欠損ニューロンでは、後シナプス表面のAMPA受容体を増やす制御機構が上手く働かないことが分かりました。以上の結果から、RNG105は、長期的なシナプス強化に必須であることが明らかになりました。
RNG105欠損ニューロンではシナプス付近への伝令RNAの配置が低下
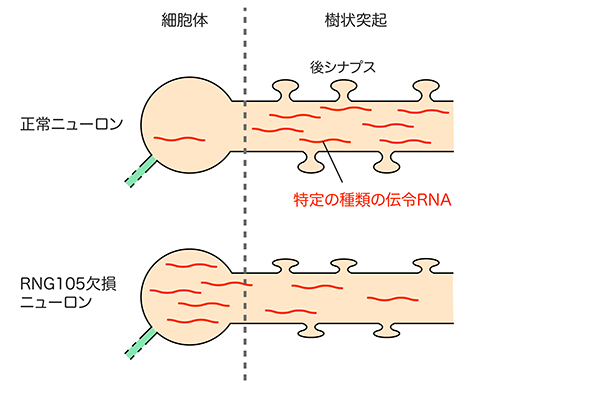
では、RNG105欠損マウスの異常はなぜ生じるのか? その原因を探るため、RNG105の欠損が伝令RNAに及ぼす影響を解析しました。ニューロンの細胞体および樹状突起(後シナプスが多く存在する突起)から伝令RNAを抽出し、次世代シークエンスという手法を用いて、数万種類の伝令RNAそれぞれの量を測定しました。
その結果、通常ではニューロンの樹状突起に偏って存在する特定の種類の伝令RNA群が、RNG105欠損ニューロンの樹状突起では、その偏りが低下していることを見出しました。このことは、RNG105欠損ニューロンでは、後シナプスの近くに伝令RNAをあまり配置できていないことを意味しています。そのような伝令RNA群の中には、シナプス強化に働くタンパク質の設計図である伝令RNAが多数含まれていることが、遺伝子オントロジー解析からわかりました。
以上のことから、通常のニューロンでは、RNG105によって樹状突起の後シナプス付近に伝令RNAが配置され、それをもとに合成されるシナプス強化タンパク質が後シナプスへ供給されており、そのことがシナプス強化、ひいては長期記憶を形成するうえで重要な鍵を握っていると考えられました。
おわりに
今回のRNG105が長期記憶形成に必須という発見により、長期記憶形成の際のタンパク質合成がどのように起こるのか、また、どのような種類の伝令RNAからタンパク質が合成されるのかについて、新たな知見が得られました。また、本稿では紹介しませんでしたが、RNG105は巨大な複合体である「RNA顆粒」の主要な構成因子です。RNA顆粒の異常は、認知症、筋萎縮性側索硬化症(ALS)、自閉症スペクトラム障害(ASD)など、さまざまな神経精神疾患の原因になることが明らかにされつつあります。したがって今回の発見を足がかりにして、長期記憶形成の分子メカニズムがさらに解明されることに加え、臨床・創薬分野の応用研究にも道を開くことが期待されます。
参考文献
Nakayama K*, Ohashi R*, Shinoda Y, Yamazaki M, Abe M, Fujikawa A, Shigenobu S, Futatsugi A, Noda M, Mikoshiba K, Furuichi T, Sakimura K, Shiina N. (*equal contribution) (2017) RNG105/caprin1, an RNA granule protein for dendritic mRNA localization, is essential for long-term memory formation. eLife 6, e29677.
Ohashi R, Takao K, Miyakawa T, Shiina N. (2016) Comprehensive behavioral analysis of RNG105 (Caprin1) heterozygous mice: Reduced social interaction and attenuated response to novelty. Sci. Rep. 6, 20775.
Shiina N, Yamaguchi K, Tokunaga M. (2010) RNG105 deficiency impairs the dendritic localization of mRNAs for Na+/K+ ATPase subunit isoforms and leads to the degeneration of neuronal networks. J. Neurosci. 30, 12816-12830.
この記事を書いた人

-
椎名伸之(写真右)
自然科学研究機構 基礎生物学研究所/岡崎統合バイオサイエンスセンター 准教授。ERATO月田細胞軸プロジェクトでの研究員時代にRNG105を発見。国立遺伝学研究所、東工大での助教時代にニューロンでの研究を開始。現在はマウスを用いて、RNA顆粒の形成・解体メカニズムから脳機能への影響までを研究。
中山啓(写真左)
自然科学研究機構 基礎生物学研究所/岡崎統合バイオサイエンスセンター 助教。細胞が刺激に応じて適切に応答する仕組みについて研究。現在の興味は、シナプス強化に伴う細胞内の変化や加齢に伴う影響。
大橋りえ(写真中)
東京理科大学卒業。総合研究大学院大学 生命科学研究科 基礎生物学専攻 5年一貫制博士課程に在籍中。RNA顆粒の時代が来ると予想中。




