拡散により植物モルフォゲンの濃度勾配ができる仕組み
魅力的な拡散-濃度勾配モデル
生きものが形づくられるとき、細胞は活発に分裂し、そして、さまざまな機能に特化していきます。その仕組みを総合的に理解しようとするのが発生学です。形そのものの美しさや、それをつくる仕組みの巧妙さに魅せられ、発生学者は日々研究を楽しんでいます。このように研究をする動機はわかりやすいのですが、発生は分子・細胞・組織と階層をまたいで起こる複雑な現象なので、その仕組みを解くのは簡単ではありません。
半世紀ほど前にLewis Wolpert博士は、遺伝情報から生み出される分子が組織の中に濃度勾配を作り、それぞれの細胞が周りの分子の濃度を感じることで異なる機能を獲得する、というアイデアを提案しました。時を同じくしてFrancis Crick博士は、生体内におけるそのような分子情報の濃度勾配が、シンプルな物理現象「拡散」により作られうることを指摘しました。これらの拡散-濃度勾配モデルは、複雑で精妙な発生現象をスッキリ説明する魅力的な仮説です。実際に、組織の一部で生産され、細胞間を輸送されることで組織全体に濃度勾配をつくり、それに応じて細胞をコントロールする分子(モルフォゲン)がいろいろと同定されました。しかし、一部を除き、シンプルな拡散で濃度勾配ができているわけではないことが明らかになり、次第に拡散モデルは非現実的なものと考えられるようになりました。
いつものイスに座って議論
モルフォゲンに関する研究は動物の発生を中心に発展してきました。一方、動物のモルフォゲンと同じ分子は植物には存在しません。ホルモンの一種オーキシンや、根の発生に関わるPLETHORAやROOT MERISTEM GROWTH FACTOR(RGF)といった分子が挙げられるくらいです。ところが、筆者の一人(川出)は、濃度依存的に葉の細胞分裂をコントロールするANGUSTIFOLIA3(AN3)という転写コアクチベーター分子が、細胞間を移動していることを見つけていました。興味深いことに、AN3は葉の基部側のみで生産され、先端部へ向かって滑らかな濃度勾配をつくります。この濃度勾配は分裂する細胞の分布とよく合うので、モルフォゲンという観点から着目して研究を進めていました。それをさらに発展させる転機は、研究により定量的・理論的な視点を組み込むことでした。
筆者のもう一人、谷本は川出の大学院の同級生で、細胞移動の物理学を研究していました。川出と谷本は毎晩のように上野アメヤ横丁(アメ横)のパイプ椅子に座り、安い酒を呑みながら“面白い研究とはなにか”について議論をしていました。そのなかで、分子の細胞間の移動を植物で定量するアイデアが浮かんできました。
植物の細胞は隣の細胞と原形質連絡というトンネル状の構造で直接につながっています。この構造は直径が数10nmもあるので、タンパク質のような大きな分子でも通過できます。この特有の構造により、植物では動物とはまったく異なる分子移動が起こっています。原形質連絡を介した分子の移動を定量的に調べたら、何か面白いことが見つかるのではないだろうか? というアイデア(と、もちろん酒に)酔った私たちは、一緒に研究を始めました。
とりあえず測ってみるという姿勢
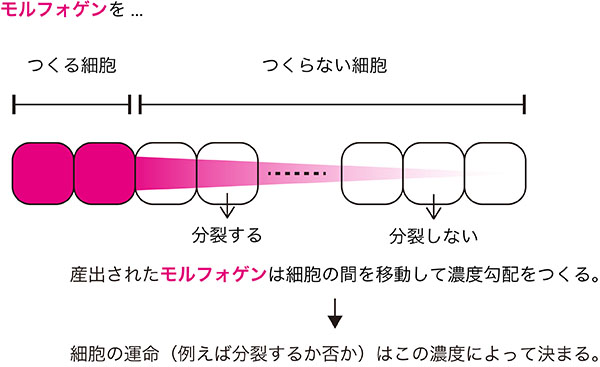
私たちは緑色蛍光タンパク質GFPを使い、葉原基の基部と先端部における、一細胞および組織(50細胞程度)レベルでの分子の移動能を測定しました。ここでは、光退色後回復法(FRAP, Fluorescence Recovery After Photobleaching)という実験手法を用いました。GFPはレーザー照射により蛍光が退色しますが、照射した領域の外側からGFPが移動してくるので、レーザー照射した領域の蛍光が回復します。この回復カイネティクスを理論的に解析することで、GFP分子の移動能が定量できます。一細胞レベルでの実験から、GFPは原形質連絡の中を拡散的に移動していることがわかりました。この一細胞レベルの拡散性は基部と先端部で同じでした。
(上)全身で緑色蛍光タンパク質(GFP)を作っているシロイヌナズナ株の葉をFRAP解析の実験材料にして、原形質連絡を通るタンパク質の移動能を調べた。マゼンタ色で囲っている中央の1細胞にレーザーを照射すると、GFP分子の蛍光が退色する。引き続き観察していると、周囲の細胞からGFPが移動して来ることで、中央の細胞の蛍光強度は回復する。スケールバーは10µm
(下)GFP蛍光強度の変化を時間の経過とともに示すと、指数関数的に回復していることがわかる。これは、GFPが原形質連絡の中を拡散していることを意味する
しかし、ここで大きな疑問にぶつかりました。組織レベルでの実験では、基部と先端部で移動能が違ったのです。一細胞レベルでは差がないのに、なぜ組織レベルでは差がでるのでしょうか。組織レベルでのタンパク質の積極的な輸送など、考えられる可能性はいくつかあります。それらを検討するため、実測値を組み込んだ数理モデルを構築しました。
その結果、細胞の大きさが、組織レベルでの分子移動能を決める重要な要素だとわかりました。葉の原基では、細胞の分裂が基部で盛んであり、先端部へ向かい低下します。分裂が活発な小さな細胞の領域では原形質連絡をいくつも通らないといけないので、一定距離を移動するのにより多くの時間がかかります。したがって、基部の組織レベルの移動能が先端部より小さくなる、という結論にたどり着きました。わかってしまうととても簡単なことなのですが、組織内の分子動態を考えるうえで細胞の大きさが重要な要素だという報告は今までありませんでした。このような先行研究が見落としていた点に気付けたのは、先入観なしに、まずは測ってみようという姿勢で研究に挑んだからだと考えています。
Crick博士の残した宿題を解く
葉原基におけるGFPのFRAP解析から、細胞の分裂活性が偏在するとき、組織レベルで拡散性に違いが生じるということがわかりました。これは、拡散モデルを考えるうえで大切な点です。そこで私たちは、改良版・拡散モデルでAN3の濃度勾配ができる仕組みを解くことに挑戦しました。まず、GFPを3つ融合させて分子量を大きくし、原形質連絡を通れないようにしたAN3(AN3-GFP-GFP-GFP)の濃度勾配を解析し、AN3が分裂による細胞の持ち越しのみでどの程度先端部へ広がるのか明らかにしました。この組織成長の作用を改良版・拡散モデルに組み込み、細胞間を移動できるAN3-GFPの濃度勾配を解析したところ、理論的な推定値と実測値が見事に合いました。つまりAN3の濃度勾配は、シンプルな物理現象「拡散」が成長する組織内で起こることで形作られるのです。ただし、組織レベルで拡散性が変化することは忘れてはいけません。
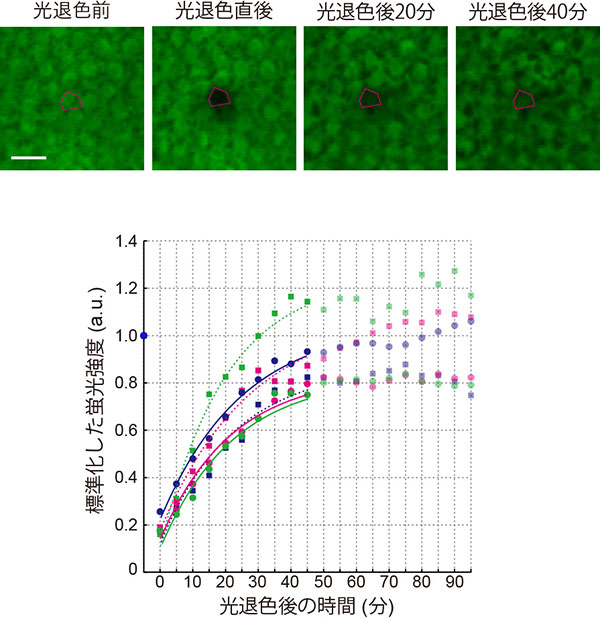
(上)遺伝子操作により細胞の間を移動できなくしたAN3、もしくは、移動できるAN3を作る葉の写真を示す。どちらのAN3にもGFPが融合しているので、GFPの蛍光でAN3の分布を検出できる。葉の写真とGFPは、同じ葉を同じ視野で撮影している。移動できないAN3に比べて、移動できるAN3では分布が拡大しており、これは細胞の分裂頻度と対応していた。スケールバーは50µm
(下)AN3濃度勾配の実験と理論との比較。移動できるAN3は葉の基部側20µm程度で限定的に産出され、先端部へと移動することで濃度勾配をつくる。水色は実測値、黒色は拡散モデルによる理論値を示す。両者がきれいに一致するのが見て取れる
これにて、Francis Crick博士が後世に出した宿題「拡散モデルを生体内で示す」は葉で解決しました。
新しい問題を求めて
今後の課題はたくさん挙げられます。たとえば、葉原基の基部におけるAN3生産量がどのようにして決まっているのか、というのはわかっていません。また、AN3の拡散性を詳細に調べるのも大切です。このように目の前にある課題を解くこともしますが、まだ誰も気付いていない問題を見つけたいとも考えています。そこで、葉原基における分裂の活性や方向、細胞の大きさや形などを時空間的に定量する準備を進めています。例のごとく、とりあえず測ってみるという姿勢です。これにより、AN3濃度勾配のダイナミクスと細胞の振る舞いをつなぐ新しい鍵が見つかると信じています。
当時の私たちにとってアメ横は大きな発見でした。しかし、今でもどんどんと発展していて、以前とは少し違います。これは良いことで、慣れた場所に留まらず次へ行けと言っているのでしょう。
参考文献
Kawade K, Horiguchi G, Usami T, Hirai MY, Tsukaya H.
“ANGUSTIFOLIA3 signaling coordinates proliferation between clonally distinct cells in leaves”
Current Biology, 23: 788-792 (2013).
Kawade K, Tanimoto H.
“Mobility of signaling molecules: the key to deciphering plant organogenesis”
Journal of Plant Research, 128: 17-25 (2015).
Kawade K, Tanimoto H, Horiguchi G, Tsukaya H.
“Spatially different tissue-scale diffusivity shapes ANGUSTIFOLIA3 gradient in growing leaves”
Biophysical Journal, 113: 1109-1120 (2017).
この記事を書いた人

-
川出健介(写真左)
岡崎統合バイオサイエンスセンター・特任准教授
(兼任)基礎生物学研究所/総合研究大学院大学・特任准教授
2011年に東京大学 大学院理学系研究科 生物科学専攻で博士(理学)を取得後、基礎科学特別研究員(理化学研究所 環境資源科学研究センター)と日本学術振興会特別研究員PD(北海道大学 大学院理学研究院)を経て、2015年から現職。発生現象における定量・理論的な側面と、代謝制御の側面に今は興味がある。
谷本博一(写真右)
フランス国立ジャックモノー研究所・博士研究員
2012年に東京大学 大学院理学系研究科 物理学専攻で博士(理学)を取得後、現職。博士課程から一貫して、細胞の階層で見られる生体運動の力学的な側面に興味を持っている。
この投稿者の最近の記事
 研究成果2017年10月13日拡散により植物モルフォゲンの濃度勾配ができる仕組み
研究成果2017年10月13日拡散により植物モルフォゲンの濃度勾配ができる仕組み



