私たちの細胞が持つ、「こわす」仕組みの多様性 – オートファジーにはいくつもの経路がある
細胞内の「こわす」仕組みの重要性
生物の基本単位である細胞の中では、その構成成分(タンパク質、脂質、核酸など)の絶え間ない合成と分解が起こっています。細胞活動を維持するためにこれらの合成が必要なことは理解しやすいですが、実は分解もまた重要な役割を担っています。なぜ、分解(こわすこと)が重要なのか、という問いに対しては、2つ答えがあります。
ひとつは、細胞の外部から得られる構成成分の材料(アミノ酸など)の供給では、合成に必要な材料の需要に追いつかない場合が多く、細胞内の余剰の構成成分を分解し新たな合成の材料として(リサイクルして)使う必要があるから、というものです。
もうひとつは、細胞内の構成成分が変性し、細胞に対して毒性を与えるものになる場合があり、その除去が細胞の活動維持に必要となるケースがあるからです。このようなことから近年、細胞内の分解システムの研究が進展・脚光を浴びており、2004年にはユビキチン・プロテアソームシステムによるタンパク質分解機構の発見がノーベル化学賞を受賞し、そして2016年には大隅良典博士によるオートファジーメカニズムの発見がノーベル医学生理学賞を受賞しました。
オートファジーにはいくつもの経路がある
オートファジー(日本語では自食作用)は、細胞内部の構成成分をリソソーム(酵母、植物では液胞)と呼ばれる場所(細胞内小器官)に輸送してから分解する働きの総称で、私たちを含む真核生物全般が持つ仕組みです。大隅博士のニュースのおかげで、科学者のみならず一般の方々にもオートファジーという言葉は認知されるようになりました。
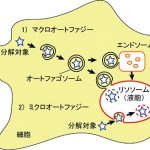
リソソームは袋状の構造をしているので、その中にものを輸送するには仕掛けが必要です。私たちの細胞が持つ仕掛けの主要なものとして、1)こわすべきものを包むように細胞内に新たな二重膜の袋、オートファゴゾームを作り、オートファゴゾームの外側の膜の一部がリソソーム膜と融合するか、エンドソームと呼ばれる別の細胞内小器官の膜と融合した後、リソソームとさらに融合する、また2)リソソーム膜が直接、陥入などの変形を起こしてこわすべきものを取り囲み、陥入口を閉じてこわすべきものを含んだ袋をリソソーム内に切り離す、というものがあります。
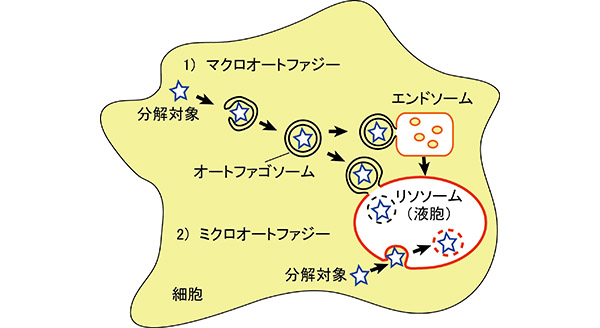
1)をマクロオートファジー、2)をミクロオートファジーと呼んでいます。大隅博士のご研究は、1)のマクロオートファジーの分子機構を明らかにしたものですが、その研究の結果、マクロオートファジーに機能する多くの因子、Atg(Autophagy-related)タンパク質が見つかり、それらが私たちの生・老・病・死のさまざまな局面で重要な働きをすることがわかりました。
しかしながら、リソソーム膜自体に存在するタンパク質をこわすべき局面では、 2)のミクロオートファジーの仕掛けを使う方が効率的であるのは明瞭です。実はこれまでの研究では、リソソーム膜のタンパク質がミクロオートファジーによって本当にこわされるのか、またこわされるとすればどのような分子機構によるものなのかは不明でした。
ミクロオートファジーによる酵母液胞膜タンパク質の分解
私たちは酵母Saccharomyces cerevisiaeを対象とした研究から、液胞(リソソーム)膜を貫通して存在する複数のタンパク質が生育条件の変化に応じて分解されること、その際に液胞膜の陥入が見られることを見出しました。これらの発見で、ミクロオートファジーによって液胞膜タンパク質が分解されることが強く示唆されたのですが、このことをきちんと証明するためには、液胞膜陥入の仕掛けに機能するタンパク質を明らかにし、それらが確かに液胞膜の表面にやってくることを示す必要があります。
私たちは、エンドソームを陥入させることが知られていたESCRTタンパク質と呼ばれる因子群が液胞膜タンパク質分解に必要なこと、またその分解が誘導される際にはESCRTタンパク質のうちのひとつ、Vps27が液胞膜の表面にやってくることを見出しました。これらのデータを総合することで、液胞膜の一部がESCRTタンパク質の働きで陥入して液胞の内部に輸送され、そこに位置していた膜タンパク質が分解されるミクロオートファジーの全体像が見えてきたわけです。
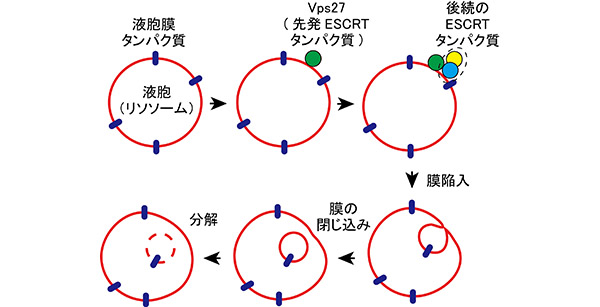
一方でこの過程には、マクロオートファジーにおいてオートファゴゾームを作るのに必要なAtgタンパク質は不要でした。
こわす仕組みの多様さが私たちの細胞の健常性を支えている
ここでご紹介した研究は酵母を対象としたものですが、最近では哺乳類の胚発生過程でもミクロオートファジーが重要な働きをもつことが、日本の研究グループから発表されています。
また、リソソーム膜上のタンパク質が核酸(RNAなど)を取り込んで分解する分子機構も日本で解明されました。
このように、新たな膜をつくる(Atgタンパク質による)働きや、既存の膜を曲げる(ESCRTタンパク質による)働きなど、多様な仕掛けを使ってオートファジーは成り立っています。私たちの生活で、目的地への交通手段がいろいろある方が便利で万一の場合でも安心なように、細胞にも「こわす」ためのさまざまな輸送の仕組みがあり、細胞活動を支えています。今後の多くの研究を経て、これらの仕組み同士の機能ネットワークの全貌が明らかになることが期待されます。
参考文献
1. OKU M., MAEDA Y., KAGOHASHI Y., KONDO T., YAMADA M., FUJIMOTO T., SAKAI Y. (2017) Evidence for ESCRT- and Clathrin-dependent Microautophagy. The Journal of Cell Biology. DOI: 10.1083/jcb.201611029
2. KAWAMURA N., SUN-WADA G.H., AOYAMA M., HARADA A., TAKASUGA S., SASAKI T., WADA Y. (2012) Delivery of Endosomes to Lysosomes via Microautophagy in the Visceral Endoderm of Mouse Embryos. Nature Communications. DOI: 10.1038/ncomms2069
3. AIZAWA S., FUJIWARA Y., CONTU V.R., HASE K., TAKAHASHI M., KIKUCHI H., KABUTA C., WADA K., KABUTA T. (2016) Lysosomal Putative RNA Transporter SIDT2 Mediates Direct Uptake of RNA by Lysosomes. Autophagy. DOI: 10.1080/15548627.2016.1145325
この記事を書いた人

- 京都大学 大学院農学研究科 助教。 2003年3月、京都大学大学院農学研究科・後期博士課程修了、博士(農学)学位取得。2005年4月より2008年3月まで、自然科学研究機構・基礎生物学研究所・大隅良典研究室にて学術振興会特別研究員(PD)。2008年7月より現職。酵母の持つさまざまな知恵・しくみのうち、特に細胞内の脂質・膜の動きやレドックスを制御するメカニズムを明らかにし、私たちの生活に役立つ新たな技術の種を生み出すことを目標に研究しています。