我々はどうやって青色を見ているのか? – 霊長類青センサータンパク質の構造解析
光と色
私たちが普段見ているすべての色は、「光の三原色」と呼ばれる青・緑・赤の3種類の光の組み合わせのパターンによって作られます。つまり、「光」は「色」の源なのですが、光がありさえすれば色が存在するわけでもありません。太陽や電球など、光源からの光がものに当たると、ある特定の波長のみが反射され、残りの波長は吸収されます。私たちはこの反射された波長の光を眼で受け取り、脳に伝えることではじめて色を認識できるのです。私たちの眼には、物体によって反射されたさまざまな波長の光を感じる2種類の細胞があり、とりわけ暗闇でのわずかな光を感じ、モノを見ることを得意とする桿体視細胞、そして色識別に特化した錐体視細胞があります。
私たちの研究室では、これら視細胞の中に存在する光センサータンパク質の研究を行っています。5ナノメートル(1ナノメートル=10億分の1メートル)という小さな分子がどうやってさまざまな波長の光を見分け、光情報を脳に伝えているのか、原子・分子といった言葉で解き明かすことに奮闘しています。
色を見分ける3種類の光センサータンパク質
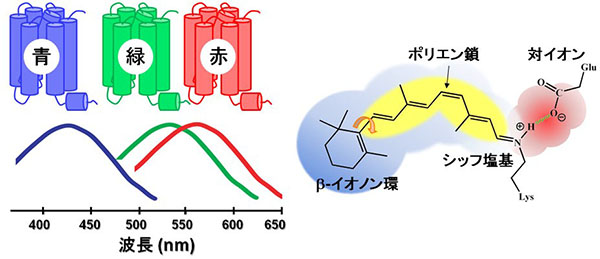
私たちの色覚を担う光センサータンパク質は、「光の三原色」に対応した青・緑・赤の3種類が存在します。一般的に光センサータンパク質は光を吸収するために、タンパク質内部に発色団と呼ばれる化学分子を結合させています。たとえば植物であれば、光合成などを行うために赤や青の光の波長に適した異なる発色団分子(フィトクロム、クリプトクロム)をタンパク質内部に結合させていますが、興味深いことに、3種類の色覚センサータンパク質は11シス型レチナール(ビタミンA誘導体)というまったく同一の発色団分子を使って異なる色の光を吸収しています。これはタンパク質を構成するアミノ酸とレチナールがそれぞれ特異的な相互作用をすることで、さまざまな波長の光吸収が実現されると考えられています。
したがって、私たちが色を見分けるしくみを理解するためには、それぞれの色覚センサータンパク質がレチナールとどのような化学的な相互作用を行っているのか、波長制御機構を明らかにする必要がありますが、1)色覚センサータンパク質の試料調製が困難なこと、2)限られた試料に対する構造解析手法が存在しないこと、3)実験操作のすべてを暗室で行わないといけないことからタンパク質の構造研究は皆無であり、私たちが色を見分けるという当たり前のことを、分子レベルで説明できなかったのです。
赤と緑を見分ける色覚センサータンパク質の構造解析
タンパク質の構造解析と聞いてまず思い浮かべる解析手法は、X線結晶解析法や電子顕微鏡法、さらには核磁気共鳴法(NMR法)でしょう。これらの手法は原子レベルでの精緻な構造情報を与えてくれることから、タンパク質の立体構造を決める手法として広く利用されています。一方で構造解析にはタンパク質の生物学的機能研究に比べて、桁違いの試料量が必要になります。
そこで私たちは京都大学霊長類研究所の今井啓雄准教授との共同研究により、10年前に赤外線を用いた振動分光法(赤外分光法)によるサル色覚センサータンパク質の構造解析を開始しました。赤外分光法は原子や分子の位置情報を得られない一方、それらの化学構造や、状態変化に対応した構造変化を追跡することもできます。なにより、X線結晶解析法やNMR法の一桁低い試料量で測定が可能なため、試料調製が困難な膜タンパク質にとってうってつけの構造解析手法なのです。
私たちは、哺乳類ガン細胞を用いたタンパク質の大量発現と高精度低温赤外分光法を組み合わせることで、2010年に世界で初めて霊長類赤・緑センサータンパク質の構造解析に成功し、続くタンパク質内部に結合した水分子の解析および同位体標識したレチナールを用いた解析成果によって、私たちが赤と緑を見分ける分子機構の解明に成功しました。
一方、青センサータンパク質は、過去の文献によれば、赤・緑センサータンパク質よりも一桁近く発現量が少ないことが知られており、赤外分光法を持ってしても構造解析は不可能であると考えられていました。

霊長類青センサータンパク質の構造解析
今回、青センサータンパク質の構造解析に向けて、霊長類間での種の選択やタンパク質の可溶化・精製条件の再検討を行い、赤外分光法を実行するのに十分量の精製試料を得ることに成功しました。その結果、研究開始から10年越しに青センサータンパク質の構造解析を達成することができました。
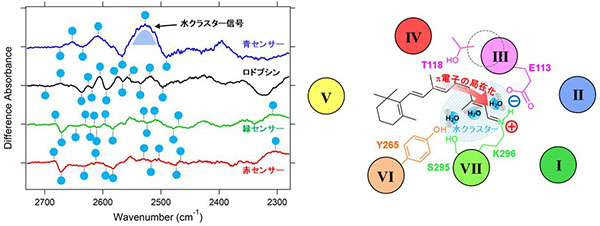
得られた青センサータンパク質の赤外吸収スペクトルは、レチナールの分子構造やタンパク質の骨格構造が赤・緑センサータンパク質とは大きく異なっていました。特に顕著な違いが確認されたのが内部結合水の信号です。本実験では重水(D2O)中、77Kでの液体窒素温度下での光照射により、始状態と異性化後の中間体との赤外差スペクトルを測定していますが、赤・緑センサータンパク質には6~8個の水のO-D伸縮振動モードがシャープなピークとして観察されました。青センサータンパク質の場合、始状態に4個、異性化中間体に3個と数は少なかったものの、2500cm-1振動数付近に半値幅が40cm-1を超えるブロードで強度の大きな水のピークが含まれていました。私たちの研究室で系統的に行ってきたさまざまな光センサータンパク質の内部結合水解析においてもこのような信号が得られたことはありませんでした。
私たちは青センサータンパク質中において、疎水的な化学構造を有するレチナール分子の近傍に複数の水分子が集合体(クラスター)を形成していると解釈しました。さらに波長制御に重要な役割を及ぼすアミノ酸の部位特異的な変異体の赤外吸収スペクトルで水の信号が減少したことから、水分子の集合体構造がレチナールのポリエン鎖上のπ電子の局在化を引き起こすことで青色光吸収をもたらすものと考えています。
今後の展開
私たちの色の認識は、「光の三原色」に対応した青・緑・赤の3種類の色覚センサータンパク質が外界からの光を吸収することから始まるわけでありますが、実際には私たちは眼ではなく脳で色を認識しています。これは、個々の色覚センサータンパク質が吸収したさまざまな波長の光情報が、視細胞内の別のタンパク質(Gタンパク質)を介して電気信号に変換されることで脳に伝えられています。
そこで今後は、色覚センサータンパク質とGタンパク質との相互作用を原子レベルで解析することで、私たちの色認識における光シグナル伝達の詳細なメカニズムを明らかにしていきたいと考えています。特に、色覚センサータンパク質は3種類あるにもかかわらず、光情報を最初に受け取るGタンパク質は1種類しかありません。したがって、それぞれの色覚センサータンパク質とGタンパク質との相互作用の共通性、特異性を赤外分光測定から見出し、私たちが色を見分けるしくみの謎に迫っていきたいと考えています。
参考文献
Katayama K, Furutani Y, Imai H, & *Kandori H.
“An FTIR study of monkey green- and red-sensitive visual pigments” (2010) Angew. Chem. Int. Ed., 49, 891-894.
Katayama K, Furutani Y, Imai H, & *Kandori H.
“Protein-bound water molecules in primate red- and green-sensitive visual pigments” (2012) Biochemistry, 51, 1126-1133.
Katayama K, Nonaka Y, Tsutsui K, Imai H, & *Kandori H.
“Spectral tuning mechanism of primate blue-sensitive visual pigment elucidated by FTIR spectroscopy” (2017) Scientific Reports, 7, 4904-4913.
この記事を書いた人

-
片山耕大(写真左)
日本学術振興会特別研究員(DC1-DC2(学振育志賞特別枠))を経て、2013年9月名古屋工業大学大学院工学研究科半期繰上げ修了:博士(工学)。2014年1月よりケースウエスタンリザーブ大学薬学部薬学研究科にて日本学術振興会海外特別研究員(PD)。2017年1月より名古屋工業大学大学院工学研究科助教。一貫して私たちの色を見分けるメカニズムの解明に向けて、赤外分光測定やX線結晶構造解析など、生物物理学的手法を用いて色覚センサータンパク質の構造解析の研究に取り組んでいます。
神取秀樹(写真右)
1989年京都大学大学院理学研究科修了:京大理博。1990年分子科学研究所博士研究員、1992年理化学研究所博士研究員、1993年京都大学理学部助手、1999年同講師、2001年名古屋工業大学助教授を経て、2003年同教授。




