リン酸化酵素が神経細胞で担う機能とは? – 概日リズム障害と加齢依存的な運動異常を示す変異マウス
神経細胞による概日リズムおよび運動の制御
神経系は生体の恒常性維持のためにさまざまな機能を制御しています。概日リズムや運動の制御は、神経系の重要な役割のひとつです。概日リズムは約24時間で周期的に繰り返す睡眠・覚醒などの生理現象です。昼夜で変化する外界の環境に適応するために必要であり、概日リズムを制御する中枢は脳に存在し、神経伝達物質やホルモン分泌を介して全身の個々の細胞に存在する細胞時計を制御します。
また、神経細胞が持つ非常に長い突起(軸索)は、脳からの信号を直接筋肉に伝えており、素早く自分の思い通りに手足を動かすことを可能にしています。怪我により神経が損傷すると筋肉を動かせなくなりますが、加齢によっても筋肉は衰え、運動能は低下します。それゆえ、高齢化が進む昨今、加齢に伴う運動能低下のメカニズムの解明は重要な課題となっています。私たちは、こうした複雑な神経機能の制御を、分子の観点から明らかにする研究に取り組んでいます。
リン酸化酵素 MKK7とは?
私たちが注目したのは、リン酸化酵素であるMKK7という分子です。MKK7は、標的分子のリン酸化を介して多様な細胞応答を引き起こします。これまでにMKK7は、ストレスに応答して細胞死を誘導するシグナルとしての事例が多く報告されてきました。一方、私たちのグループは、MKK7は細胞生存を誘導するシグナルであることを報告してきました。興味深いことに、哺乳動物培養細胞を用いた実験により、MKK7の活性が低下すると、細胞時計の周期が異常になる(伸長する)ことを発見しました。また、マウスを用いた実験により、MKK7を介するシグナルが神経系で常に活性化状態にあることを見出しました。マウス胎仔脳におけるMKK7の役割を調べるために、神経幹細胞でMKK7を欠損するマウス胎仔を作出したところ、脳の形成過程に異常を生じること、その結果、生後すぐに致死となることを明らかにしました。一方、成体マウスの神経系におけるMKK7の役割はよくわかっていません。そこで成体マウスの神経細胞特異的MKK7欠損マウス(MKK7 cKOマウス)を作出し、MKK7の機能解析を行いました。
神経細胞特異的MKK7欠損マウスの解析
MKK7 cKOマウスは致死を回避しました。興味深いことにMKK7 cKOマウスは正常マウスに比べて脳の大まかな構造に変化は見られないものの、白質と呼ばれる部分の面積が肥大し、脳重量が増加していることがわかりました。また、活動の周期を調べたところ、培養細胞の結果と同様に、周期が異常になる(周期が伸長する)こと、活動周期のメリハリが低下していることが明らかになりました。
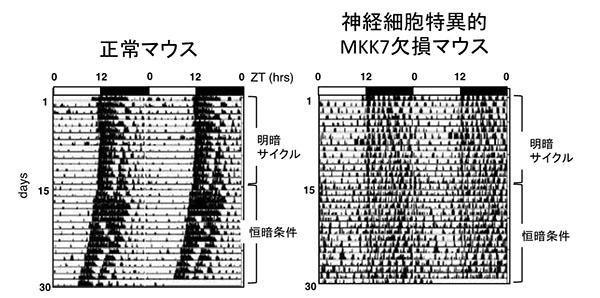
マウスは夜行性であり、正常マウス(左)は明るい時間帯(0−12時)に睡眠し、暗い時間帯(12−0時)に活動する。一方、神経細胞特異的MKK7欠損マウス(右)は、暗い時間帯での活動が低下している。 図中に散在する黒い領域はマウスが活動していることを示す。
さらにMKK7 cKOマウスでは、加齢に伴って徐々に後肢に顕著な筋力の低下を示すこと、20ヶ月齢では著しい歩行困難を示すことがわかりました。筋力の低下したマウスでは脊髄の神経軸索が変性し、骨格筋が萎縮していました。これらの結果から、MKK7は成体の神経細胞において概日リズム制御および運動能の維持に必須の役割を果たすことが明らかになりました。
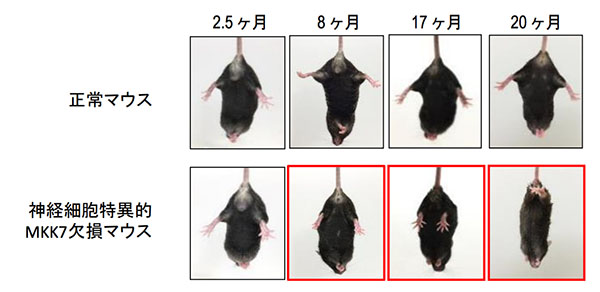
2.5ヶ月齢では正常マウスとMKK7欠損マウスでは後ろ足の開きに差はなかったが、加齢とともに(8ヶ月以降)MKK7 欠損マウスでは後ろ足の開き狭くなり、20ヶ月齢では完全に後ろ足が開けなくなった。
MKK7の役割
では、MKK7は成体の神経細胞において、どのような役割を持っているのでしょうか? 培養細胞を使った過去の研究から、MKK7が細胞内の時計タンパク質をリン酸化し安定性を変化させることで、細胞時計の周期を適切な長さに制御していることがわかっています。したがって、MKK7の欠損は、神経細胞の時計周期を変化させることにより、個体の概日リズムを変化させたと考えられます。また、運動異常を示す老齢のMKK7欠損マウスの脊髄では軸索輸送に関連するタンパク質が蓄積していることがわかりました。MKK7が誘導するシグナルは軸索輸送を担うモータータンパク質であるキネシンなどをリン酸化し、その機能を調節することが報告されています。従って、加齢に伴う運動異常は、MKK7の活性の低下によって神経細胞の軸索輸送に異常をきたし、軸索が変性した結果であると考えられます。
最後に
最近、統合失調症患者の中にMkk7遺伝子に変異がある事例が報告され注目を集めています。概日リズム障害や加齢依存的な運動能低下に関する今回の研究が、今後、精神や運動に障害を持つヒト疾患の原因解明に貢献することを期待し、研究を続けていきたいと思います。
参考文献
Tokiwa Yamasaki1, Norie Deki-Arima1, et al., (2017) Age-dependent motor dysfunction due to neuron-specific disruption of stress-activated protein kinase MKK7. Scientific Reports 7, 7348. (1Contributed equally)
この記事を書いた人

-
出来(有馬)誉恵(写真左)
2014年日本学術振興会特別研究員(DC1)、2017年東京医科歯科大学大学院博士課程(理学)修了。理学博士。夫の転勤に伴い休職中。個体の恒常性維持機構に興味を持って研究しています。
山崎世和(写真中央)
イェール大学医学部・ポストドクトラルアソシエイト。薬学博士。2010年東京大学大学院薬学系研究科機能薬学専攻博士課程修了。東京医科歯科大学難治疾患研究所を経て、2013年より現職。
脳機能を制御する分子基盤を明らかにするため、神経回路の形成と維持から現在はシナプス伝達へと領域を移し研究を続けています。
仁科博史(写真右)
東京医科歯科大学難治疾患研究所・教授。理学博士。1990年東京大学大学院理学研究科生物化学専攻博士課程修了。東京工業大学生命理工学部、トロント大学オンタリオ癌研究所、東京大学薬学部を経て、2005年より現職。
個体の形成と維持の仕組みに興味を持って研究しています。




