ビフィズス菌の糖代謝酵素の形からヒトとの共生の道すじを探る
腸内細菌は新しい糖代謝酵素の宝庫
健康なヒトの腸内には数百種以上の腸内細菌が棲んでいると言われます。腸内環境は嫌気的なので、酸素を使わない糖質の発酵にその主なエネルギー源を頼っています。ところが、ヒトが食べた食物のうち、澱粉などの消化されやすい糖質は小腸でほとんど吸収されてしまうので、主に大腸にいる腸内細菌は、食物繊維と総称されるような、ヒトの消化酵素では分解されにくい糖質を取り合って生きています。食物のなかには多種多様な糖質が含まれていますから、腸内細菌を調べると、これまで知られていなかったような新しい酵素がたくさん見つかります。以前、欧州のグループが、日本人の腸内細菌から海苔などの海藻の多糖の分解酵素の遺伝子が頻繁に見つかること、それが海洋に棲む細菌から伝播してきたと推測されることを報告して話題になりました。
糖質を加水分解する酵素はGlycoside Hydrolase(GH)と呼ばれ、見つかった順に番号を振られてファミリー分けされています。これから紹介する酵素のうち、EngBF、GLNBP、NagBb、LnbXは、それまで知られている酵素とアミノ酸配列の有為な相同性が見られなかったために、それぞれGH101、GH112、GH129、GH136という新しいファミリー番号を与えられています。また、ここでは紹介していませんが、GH121、GH127といったファミリーも、ビフィズス菌の糖代謝酵素の研究を通じて発見されたものです。一方、ごく最近の報告ですが、バクテロイデス属という成人の主要な腸内細菌からは、ペクチンを分解する酵素群のなかから新たなGHファミリーが一度に7種類も発見されました。腸内細菌の糖代謝酵素の研究は現在とても盛んになっているといえます。
ビフィズス菌は母乳に含まれるオリゴ糖や腸内の糖質を「食べて」いる
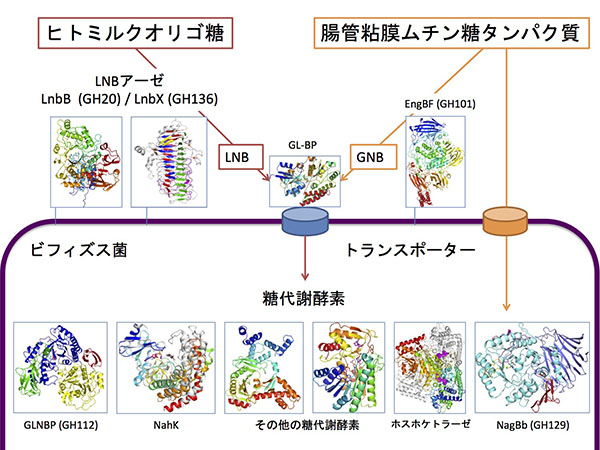
ビフィズス菌は「健康に良い」いわゆる善玉菌として有名ですが、特に赤ちゃんの腸内に多く見られます。授乳を開始すると、乳児の腸内細菌の大部分がビフィズス菌によって占められる、という一般的な事実が以前から知られており、それは近年の研究でも確かめられています。ヒトの母乳は乳糖、脂質などから成りますが、3番目に多い固形成分として、さまざまなオリゴ糖が1〜2%程度含まれており、これらは総称してヒトミルクオリゴ糖と呼ばれています。
ヒトミルクオリゴ糖は3つ以上の糖が繋がっている(乳糖以外の)オリゴ糖であり、100種類以上の成分から成ります。ヒトミルクオリゴ糖の主要な構成要素として、LNBと呼ばれる2糖(ガラクトースとN-アセチルグルコサミンがβ-1,3-結合してできています)があります。非常に興味深い事実として、このLNBが含まれるオリゴ糖は、ほとんどの哺乳動物の母乳からは見つかっていません。ボノボ、チンパンジー、オランウータンなど一部の類人猿からは見つかっているのですが、その量は少なく、LNBを含むオリゴ糖が多く含まれるのはヒトの母乳の際立った特徴なのです。
乳児の腸内にビフィズス菌を増やす因子はこのヒトミルクオリゴ糖であることが以前から知られていたのですが、それが具体的にどのようなメカニズムにもとづくのかは、長い間謎のままでした。それが約10年前に、ビフィズス菌体内でLNBを分解する酵素(GLNBP)が発見されたことから、一気に研究が進むことになります。
その後の研究で、乳児の腸内に存在するタイプのビフィズス菌は、GLNBPと下流の代謝系酵素(NahK, GalT, GalE)、そしてLNBをしっかりと結合して菌体内に取り込むトランスポーター(GL-BP)を、共通して持っていることが明らかになりました。さらに、ビフィズス菌のなかには、LNBをヒトミルクオリゴ糖から切り出す酵素であるLNBアーゼを菌体の外に持っているものがあります。
実は、この経路は、LNBとよく似たGNBと呼ばれる2糖も、取り込んで代謝することができます。GNBはヒトの腸内の粘膜の成分であるムチンと呼ばれる糖タンパク質の糖鎖として存在しており、ビフィズス菌の菌体外には、ムチンからGNBを切り離す酵素(EngBF)が見つかっています。そして、GNBのなかにはN-アセチルガラクトサミンという糖があるのですが、それをタンパク質から切り離す菌体内酵素(NagBb)も見つかりました。このことから、ビフィズス菌は、ヒトの腸内に存在する糖鎖も複数の経路を通じて栄養源にできることが明らかになっています。
ビフィズス菌の糖代謝酵素の形からわかること
私たちの研究室では、ビフィズス菌がヒトミルクオリゴ糖やムチン(糖タンパク質)を分解して代謝する一連の酵素やタンパク質の構造解析を行っています。タンパク質の立体構造から明らかになることは多く、たとえば、酵素の反応機構や基質の認識の様子が詳細にわかるようになります。
ビフィズス菌に特徴的に見られる酵素であるホスホケトラーゼは、この菌が他と違って効率の良い糖代謝経路を有するための鍵となる酵素なのですが、補酵素としてチアミン(ビタミンB1)を利用しています。その立体構造から、チアミンに結合した反応中間体(アセチルTPP中間体)にリン酸が直接反応して高エネルギー化合物(アセチルリン酸)を生産するメカニズムが明らかになりました。また、NagBbでは、N-アセチルガラクトサミンの認識に、金属イオンが関わっていることも明らかになりました。糖のN-アセチル基の認識に金属イオンが関わるということはこれまで知られておらず、ビフィズス菌の酵素を調べると、新しいことがいろいろとわかってきます。
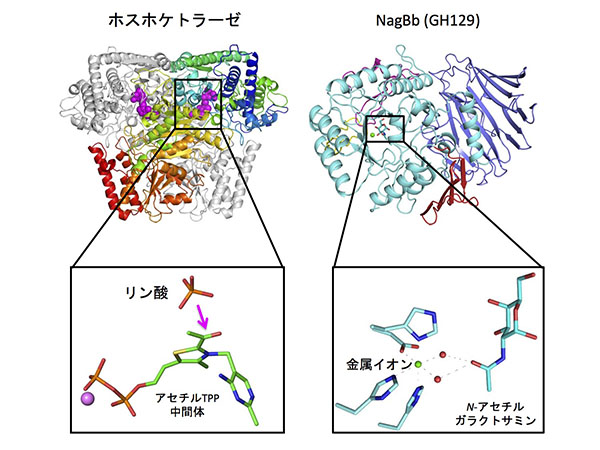
ビフィズス菌には他の微生物は持っていないようなユニークな酵素が多く存在しており、私は、これらの酵素がどのような分子進化を遂げて現在のような形や機能を持つに至ったかについて興味を持っています。たとえば、ホスホケトラーゼはペントースリン酸経路やカルビン回路などで働いているトランスケトラーゼという酵素の活性部位が変化して出来ていること、NagBbは同様にムチンの糖代謝に関わっているEngBFと少し構造が似ていることがわかりました。また、GLNBPはβ-ガラクトシダーゼという酵素と、NahKはタンパク質にリン酸基を付加する酵素であるプロテインキナーゼと、それぞれ進化的起源を共通に持っていると推測されます。ビフィズス菌は、腸内で生き抜くのに必要な、特殊な代謝系を得るために、さまざまな起源を持つ酵素を組み合わせて利用しているのではないかと考えています。
まったく異なる2種類のLNBアーゼ
ビフィズス菌のうちBifidobacterium bifidumと呼ばれる種は、GH20に属するLNBアーゼ(LnbB)を持っていますが、Bifidobacterium longumではGH136という新しいファミリーに属するLnbXというLNBアーゼを持っています。この2つの酵素はどちらもヒトミルクオリゴ糖からLNBを切り出すという同じ機能を持っているのですが、そのタンパク質としての構造や反応のメカニズムはまったく異なります。
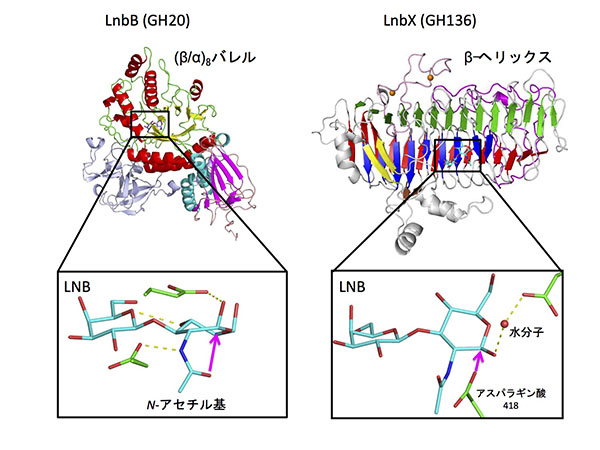
LnbBは、糖質分解酵素でよく見られる(β/α)8バレルというフォールド(タンパク質の折りたたみパターン)を持ち、同じGH20に属するβ-N-アセチルヘキソサミニダーゼという酵素のポケットが広がることによりLNBが結合できるように分子進化してきたことが推察されます。また、LNBの切断には、基質のなかのN-アセチル基自身が反応することがわかっています。
一方、LnbXは、β-ヘリックスと呼ばれるフォールドを持ち、タンパク質のなかの418番目のアスパラギン酸残基が反応して、水分子がその反応に関わることもわかりました。LnbXの進化的起源についてはよくわからないのですが、面白いことに、ファージ由来のテイルスパイクタンパク質などとも形が少し似ています。このことは、Bifidobacterium属が乳児の腸内環境でヒトミルクオリゴ糖分解を分解するにあたり、まったく異なるタイプのLNBアーゼを別々に獲得したことを示しており、非常に興味深い事実だと考えています。
ビフィズス菌に限らず、腸内細菌は、食物や宿主由来の糖質を奪い合う環境で競争しつつ、宿主との共生をはかっているとも言えます。そこでは多様な糖質分解ツールを持つ微生物が栄養状態の変化に応じて増殖のチャンスを広げられるので、新しい酵素がどんどん現れる、酵素の分子進化の実験場のような場所なのではないかと考えられます。
参考文献
Suzuki R et al & Fushinobu S (2010). Crystal structures of phosphoketolase: thiamine diphosphate-dependent dehydration mechanism. J. Biol. Chem. 285(44), 34279-34287, doi: 10.1074/jbc.M110.156281
Sato M et al & Fushinobu S (2017). The first crystal structure of a family 129 glycoside hydrolase from a probiotic bacterium reveals critical residues and metal cofactors. J. Biol. Chem. 292(29), 12126-12138. doi: 10.1074/jbc.M117.777391
Yamada C et al & Fushinobu S (2017). Molecular insight into evolution of symbiosis between breast-fed infants and a member of the human gut microbiome Bifidobacterium longum. Cell Chem. Biol. 24(4), 515-524 doi: 10.1016/j.chembiol.2017.03.012
この記事を書いた人

-
東京大学大学院農学生命科学研究科・教授
さまざまな酵素に興味があります。微生物は変わったタイプの酵素をたくさん持っているので、それらがどのような形をして、どのようにしてはたらいているかを解き明かすことを目指しています。糖質関連酵素のWebでの紹介プロジェクトCazypediaにも関わっています。
Twitter ID: @sugargroove
個人HP http://enzyme13.bt.a.u-tokyo.ac.jp/fushi/index.html
この投稿者の最近の記事
 研究成果2017年8月22日ビフィズス菌の糖代謝酵素の形からヒトとの共生の道すじを探る
研究成果2017年8月22日ビフィズス菌の糖代謝酵素の形からヒトとの共生の道すじを探る



