ドーナッツ状タンパク質に指揮されるDNA合成反応
我々の体では、1個の受精卵から約37兆個もの細胞が作られます。1回1回の細胞分裂では、生物の設計図ともいえるゲノム情報が書き込まれたDNAをすべてコピーし、新しくできる2つの細胞に伝える必要があります。DNAの複製に関する研究は、1950年代のDNA発見以来行われ、DNAを合成する酵素「DNAポリメラーゼ」を始めとするDNA複製関連のさまざまな酵素の機能が明らかにされてきました。また、これらの酵素を応用することによって、PCRやDNA配列解析などの技術が開発され、現代の遺伝子組換え技術、それに関連した産業の礎が形成されました。
これらの半世紀以上にわたる研究から、DNA複製のエッセンスとなる分子メカニズムの理解は飛躍的に進歩しました。しかし、莫大なゲノムDNAの複製は平坦な道のりではなく、 DNA合成が困難な領域、レプリソームや含まれる因子の脱落など、さまざまなインシデントが伴います。それらに対応するためにDNA複製の仕組みが用意している機能を解析することは、DNA複製研究の今後の課題です。我々は分裂酵母を使用して、DNAポリメラーゼ機能を制御するうえで欠かせないドーナツ状の分子「複製クランプ」がDNAの複製中に修飾されることに着目し、さまざまな遭遇する問題に対して、どのようにDNA合成反応がコントロールされるかを検証しました。
DNA複製装置「レプリソーム」と複製メカニズムに潜む柔軟性
ゲノムDNAはとてつもなく長く連なった塩基対のDNAからなり(ヒト:約35億、酵母:1200万塩基)、それをコピーする作業には精巧なシステムが必要です。「レプリソーム」という多くのタンパク質からなる装置によって、連続的な長い鎖であるDNAをコピーする作業が行われます。レプリソームには2つのエンジンとなる分子があります。ひとつはヘリカーゼ(螺旋を意味するヘリックスに由来)と呼ばれる分子で、ジッパーを開くようにDNAの二重螺旋を2つの1本鎖へと解きほぐし、「複製フォーク」を進行させます。もうひとつは、DNAの1本鎖を鋳型として、新しいDNA鎖を合成するDNAポリメラーゼです。これらの分子が連動して働くことにより、長いDNA鎖の複製が効率的に行われます。

これらの2つの酵素が連動して働くという点では、1点複雑な事情があります。DNAポリメラーゼは新しいDNA鎖の一方の末端(3‘末端)のみを伸ばすことができます。しかし、ヘリカーゼによって解きほぐされた2つの1本鎖DNAは、お互いに逆方向の関係になり、その方向に沿ってDNA鎖が伸長されます。よって、複製フォークの進行に対して、同方向の連続的な合成(リーディング鎖合成)、反対向きの不連続な合成(ラギング鎖合成)の繰り返しが行われます。この不連続な合成で生じる小さなDNA断片は、発見者岡崎令治博士にちなみ「岡崎フラグメント」と呼ばれます。
レプリソームの構造は柔軟なものであり、ヘリカーゼによる複製フォークの進行とDNA合成が乖離してしまうこともあります。特に、DNAの構造が損傷した場合には、DNA合成の反応が停止し、その結果として、DNA損傷の部分を鋳型とする合成を後回しにしつつ、DNA複製が行われることがあります。また、ヒト細胞を含む真核生物のレプリソームは、大腸菌などの細菌のものほど強固なものではないと考えられています。そのような意味で、DNAポリメラーゼによる合成反応がDNA複製フォークの後方で自律的に機能することが必要であり、それを制御するために、「複製クランプ」が重要な役割を果たします。
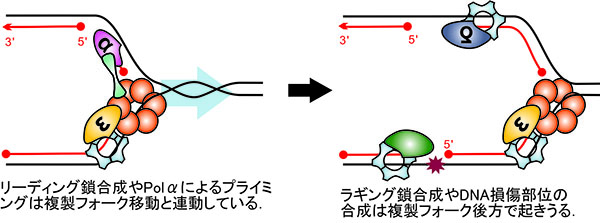
ドーナツ状分子DNA複製クランプがDNA合成の現場監督として働く
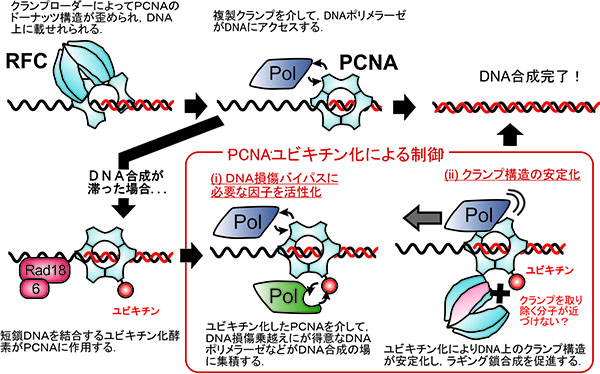
DNA複製に必要なDNAポリメラーゼなどの複製に関わる酵素の多くは、複製クランプという分子を介して、DNAと相互作用をします。複製クランプはドーナッツ状の構造をとり、RFCと呼ばれるクランプローダー分子によって、生体エネルギー依存的にその輪が開かれ、DNA上に載せられます。DNA上のクランプDNAは糸に通した輪のように移動可能であり、複製クランプと共にDNAを合成する酵素(DNAポリメラーゼ)がスライドし、スムーズなDNA合成が行われます。これは、細菌から真核生物までに保存される仕組みです。真核生物の場合は、PCNA(Proliferating Cell Nuclear Antigen)と呼ばれます。もともと、よく増殖する細胞の核に多く存在するタンパク質として発見されたため、このような名前になっています。
PCNAは単にDNAポリメラーゼなどの酵素の働きを助けるだけでなく、DNA合成が滞ったときなどに、必要なタンパク質をその場に呼び込む役割もあります。DNA合成が滞った場合は必然的に、DNAポリメラーゼの前方に鋳型となる短鎖DNAがむき出しになり、それがきっかけで、PCNAがユビキチンという小さな分子の修飾を受けます。ユビキチン化は本来、タンパク質を分解するための指標となる現象ですが、この場合は、ユビキチン化したPCNAがDNAの損傷部位に留まり、DNA損傷を乗り越えて合成を行えるDNAポリメラーゼの足場となります(以下の図中(i))。
我々の研究グループは、DNA損傷に対処する仕組みに加えて、PCNAのユビキチン化が岡崎フラグメントの合成を補助する仕組みであることを提唱しました(以下の図中(ii))。まず、「PCNAのユビキチン化がDNA合成を行っている細胞で自然と起きる現象であり、DNA合成の効率的な完了に関わるファクターであること」を示しました。また、ユビキチン化PCNAのDNA複製システムにおける役割を解析した結果、PCNAがユビキチン化によりDNA鎖上に留まりやすくなることを示し、その結果、PCNAとラギング鎖合成をおこなうポリメラーゼPolδ(デルタ)が複製の場にアクセスしやすくなることを示しました。ラギング鎖合成が滞り短鎖DNAの鋳型が残存している場合に,PCNAユビキチン化を介して Polδの機能を増強していると考えられます。岡崎フラグメントは100塩基ほど短い鎖であり、1回のゲノム複製で酵母の場合は約十万回、ヒトの場合は数千万回、その合成が繰り返されます。その際に起きうるエラーを防ぐために、PCNAの修飾によるDNA合成の現場を自律的に指揮する仕組みが意義を持つのでしょう。
最後に
「DNA複製は間違いなく行われるべき」ということが最重要事項であると考えられがちですが、正確無比なシステムだけではさまざまなトラブルに対応できません。そのような点で、複製クランプの修飾は、システムに変化を与える要素であると考えられます。DNA複製は一度走り出したら最後まで走りぬかなければならない電車のようなものです。走りながらでも自己を補正できる分子メカニズムが今後も、明らかにされるでしょう。ゲノムサイズが大きいヒト細胞では、ひとつの複製装置が長大な領域を合成するため、ゲノム上のさまざまな構造や特徴の影響が大きくなると考えられ、より柔軟なDNA複製機構が存在すると予想されます。今後はDNA複製のモデル生物である出芽酵母、分裂酵母に加えて、ヒト細胞などでの研究が進展し、がん細胞、幹細胞などの活発に増殖する細胞でのDNA複製機構を理解するうえで重要な知見が得られると考えられます。
参考文献
Y. Daigaku, T.J. Etheridge, Y. Nakazawa, M. Nakayama, A.T. Watson, I. Miyabe, T. Ogi, M.A. Osborne, A.M. Carr . PCNA ubiquitylation ensures timely completion of unperturbed DNA replication in fission yeast. PLoS Genet 13(5): e1006789, 2017
Y. Daigaku, Roadworks of DNA Damage Bypass during and after Replication, Genes and Environment. 34, 77-88, 2012 (総説)
Y. Daigaku, A. A. Davies and H. D. Ulrich, Ubiquitin-dependent DNA damage bypass is separable from genome replication., Nature. 465, 951-955, 2010
この記事を書いた人

- 東北大学理学部卒業、東北大学生命科学研究科修了、Cancer Research UK London Research Institute研究員、英国サセックス大学Genome Damage and Stability Centre 研究員、日本学術振興会海外特別研究員を経て、2015年に東北大学学際科学フロンティア研究所助教として着任。大学院生在学時以来、突然変異が起きる仕組みを探るために、DNA複製、DNA修復といったDNAの回りで起きる現象に焦点を当て、研究を行っています。現在は、ゲノム科学的、分子生物学的な技術を融合し、DNAポリメラーゼ間での協調的な役割を明らかにする事を目指しています。
この投稿者の最近の記事
 研究成果2017.07.20ドーナッツ状タンパク質に指揮されるDNA合成反応
研究成果2017.07.20ドーナッツ状タンパク質に指揮されるDNA合成反応



