酵素を“1分子ずつ”狙った場所に配置する – 多段階反応を効率的に進行させる分子コンビナートをつくる
研究の背景
細胞の中では、タンパク質をはじめとしたさまざまな分子が混在しています。しかし、いくつかの酵素は、さながら原料から各種の化成品を効率的に生産するコンビナートのように、整然と並んで化学反応を連続して進めることが知られています。この「分子コンビナート」を細胞の外で構築することができれば、効率のよい物質生産システムとして利用することができるでしょう。分子コンビナートを細胞の外で構築するためには、段階的な反応が効率よく連続して進むように、ナノメートルのサイズの異なった種類の酵素を1分子ずつ、決まった場所に並べることが必要です。これは簡単なことではありませんが、それぞれの酵素を決まった位置に高い精度ではめ込むことができる足場があれば、実現の可能性はぐっと増してきます。私たちはDNAでつくるナノ構造体「DNAオリガミ」を、その足場として利用してきました。DNAオリガミは、さまざまな形のナノ構造体を自在に設計して構築することができるだけでなく、そのナノ構造体上の狙った場所に決まった配列のDNAを導入して番地をふることができます。このDNAの番地を見分けて、酵素を運ぶ案内役があれば、狙った場所に酵素を配置することができるようになります。そのために私たちが開発したのが、DNA結合タンパク質を利用した「アダプター」です。
DNA結合性アダプター – DNAナノ構造体に酵素を1分子ずつ配置する技術
これまでにも酵素をDNAナノ構造体に配置する方法は報告されていましたが、狙った場所に、迅速かつ高い割合で酵素を配置する技術はありませんでした。私たちはすでにDNA結合性アダプターを開発していましたが、その性能をさらに向上させた「モジュール型アダプター」を開発したことで、DNAオリガミ上の決まった番地に、短時間でほぼ100%の割合で酵素を安定に配置できるようになりました。このモジュール型アダプターは、特定の基質とのあいだに共有結合を形成するタグタンパク質とDNA結合性タンパク質を融合したものです。DNA結合性タンパク質が番地のDNA配列を読み取り、タグタンパク質がDNA番地に導入された基質と速やかに共有結合を形成して、高い割合で狙った場所に酵素を安定に配置することができます。しかし、1種類のモジュール型アダプターだけでは、いくつもの種類の酵素を狙った場所に配置することはできません。分子コンビナートの創製のためには、いくつもの種類のモジュール型アダプターを開発する必要がありました。
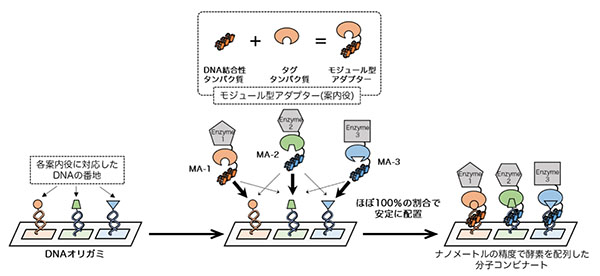
モジュール型アダプターの拡充
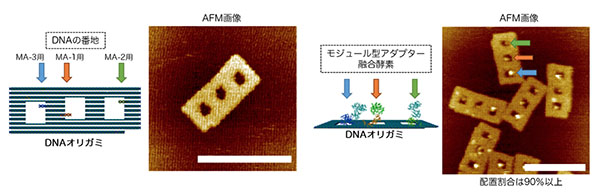
モジュール型アダプターを構成するDNA結合性タンパク質とタグタンパク質を、それぞれ3種類ずつ用意し、それらを組み合わせた9種類のモジュール型アダプターを設計しました。それらのなかから、狙った番地だけに、迅速かつ100%近くの収率で安定に配置される3種類のモジュール型アダプターを選びました。実際にDNAナノ構造体上の番地に配置されたモジュール型アダプターを原子間力顕微鏡で観察すると、3種類のモジュール型アダプターは、それぞれ90%以上の収率でDNAナノ構造体の、あらかじめ決められた番地に配置されていました。また、モジュール型アダプターが、どの番地に近づきやすいのか、そして、決められた番地に安定に配置される速度を解析することによって、決められた番地にのみ安定に配置できるモジュール型アダプターの設計原理を見出しました。これにより、今後は、あらかじめ設計して、モジュール型アダプターの種類を増やすことが可能になります。
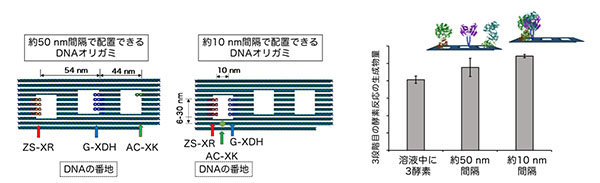
分子コンビナートの構築
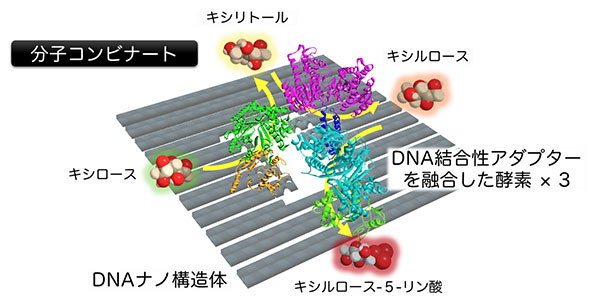
新たに開発したモジュール型アダプターを利用して、キシロースからキシリトール、キシリトールからキシルロース、そしてキシルロースからキシルロース-5-リン酸への代謝反応を触媒する3種類の酵素を並べた「分子コンビナート」を構築しました。
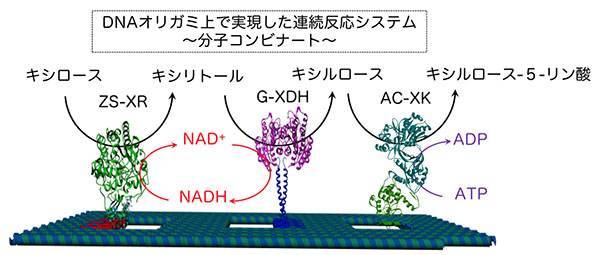
まず、それぞれの酵素に別々のモジュール型アダプターを融合しました。そして、各モジュール型アダプターに合わせた番地を導入したDNAナノ構造体に3種類の酵素を配置しました。分子コンビナートの3段階の酵素反応による生成物の収率を、同じ濃度の酵素を単に混ぜ合わせた場合と比較しました。その結果、DNAナノ構造体上に3種類の酵素を配置した分子コンビナートでは、単に混ぜ合わせた場合よりも3段階の酵素反応が効率よく進行しました。それぞれの酵素を約10nm間隔に配置すると、約50nm間隔で配置したときに比べて、さらに効率よく3段階酵酵素反応が進行しました。このことから、複雑な3段階の酵素反応においても、反応の効率をあげるためには酵素の空間配置が重要であることがわかりました。
今後の展望
モジュール型アダプターの種類を増やすことにより、DNAナノ構造体を足場として、3種類の酵素を1分子ずつナノメートル精度の距離で並べることができるようになりました。本研究の成果を応用して、モジュール型アダプターの種類をさらに増やすことによって、より複雑な多段階反応が効率よく進行する「分子コンビナート」をつくることができます。また、単に複数の酵素を混ぜ合わせただけでは進行しない、不安定な中間体を含む多段階反応も「分子コンビナート」では実現できると期待できます。さらに、細胞内の連続する代謝反応を効率よく細胞の外で再現するだけでなく、生物にはできない反応を組み合わせた人工代謝反応を実現することも可能だと考えています。
参考文献
E. Nakata, F. F. Liew, C. Uwatoko, S. Kiyonaka, Y. Mori, Y. Katsuda, M. Endo, H. Sugiyama, T. Morii Angew. Chem. Int. Ed. 2012, 51, 2421.
T. A. Ngo, E. Nakata, M. Saimura, T. Morii J. Am. Chem. Soc. 2016, 138, 3012.
T. M. Nguyen, E. Nakata, M. Saimura, H. Dinh, T. Morii J. Am. Chem. Soc. 2017, 139, 8487.
この記事を書いた人

-
中田 栄司 (写真右)
京都大学エネルギー理工学研究所 准教授。2005年 九州大学大学院工学府物質創造工学専攻博士課程修了。博士(工学)。京都大学工学研究科、スイス連邦工科大学ローザンヌ校(EPFL)博士研究員を経て、2007年徳島大学ソシオテクノサイエンス研究部 助教、2010年京都大学エネルギー理工学研究所 講師。2017年より現職。
森井 孝(写真左)
京都大学エネルギー理工学研究所 教授。1988年 京都大学大学院工学研究科合成化学専攻博士課程修了。工学博士。コロンビア大学化学科、カリフォルニア工科大学化学科博士研究員を経て、1992年京都工芸繊維大学繊維学部 助手、1994年 京都大学化学研究所 助手、1998 年京都大学エネルギー理工学研究所 助手、2002年同講師。2005年より現職。
森井研究室HP: http://akweb.iae.kyoto-u.ac.jp/material




