パーキンソン病の病因に迫る − αシヌクレインの神経伝達に対する毒性とそのメカニズム
パーキンソン病とαシヌクレイン
パーキンソン病は世界で約1千万人の人々が罹患している神経疾患で、日本では1000人に1〜1.5人、60歳以上では100人に1人が発症していると言われています。この病気は制御不能なふるえ、姿勢保持障害、動作緩慢などの進行性の運動機能障害を特徴とし、中枢神経細胞、特に中脳の黒質ドーパミン神経細胞の機能障害、次いで神経変性、細胞死が原因で発症します。
しかしその発症原因はまだわかっておらず、根治療法もありません。研究者は長年、病因の解明と治療法の開発に取り組んできましたが、1990年代にαシヌクレインというタンパク質の過剰発現がパーキンソン病の発症に関わっていることが明らかになりました。αシヌクレインは主に脳の神経細胞に発現するタンパク質で、特に神経細胞の軸索終末端に局在する機能不明のタンパク質です。パーキンソン病は神経細胞に過剰に発現したαシヌクレインが凝集・蓄積し、神経変性や細胞死を引き起こすことで発症すると考えられています。
神経伝達と小胞エンドサイトーシス
神経細胞間の情報伝達は、シナプスと呼ばれる神経細胞どうしの接点で行われます(シナプス伝達)。神経細胞の電気信号である活動電位が神経軸索終末端に到達すると、終末端から神経伝達物質が放出されます。隣接する神経細胞(後シナプス細胞)は放出された伝達物質を受容し、電気信号に変換して次の神経細胞へと情報を伝達します。神経伝達物質は軸索終末端内のシナプス小胞と呼ばれる小さな袋に収納されており、この小胞が終末端膜と融合して開口することによってシナプス間隙(終末端と後シナプス細胞との隙間)へと放出されます。開口放出の後、終末端膜に融合したシナプス小胞は末端内に取り込まれ、新たなシナプス小胞として再利用されます。この融合した小胞の取込過程を小胞エンドサイトーシスと呼びます。小胞エンドサイトーシスが阻害されると、消費したシナプス小胞の再生・補充が間に合わなくなり、シナプス小胞が枯渇してシナプス伝達の効率が落ちてしまいます。
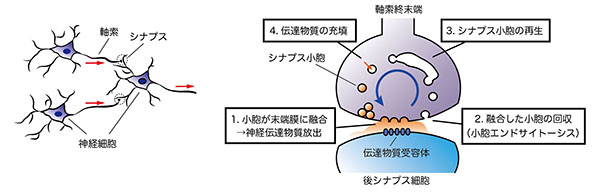
(右)神経細胞どうしの接合部をシナプスと呼ぶ(点線丸部分)
(左)神経伝達物質放出の模式図。シナプス小胞が軸索終末端膜に融合することで小胞内の伝達物質が放出され、後シナプス細胞の受容体によって検出される。融合したシナプス小胞は末端内に取り込まれ、伝達物質の再充填を経て新たな小胞として再生される
αシヌクレインは通常、軸索終末端に局在していますが、パーキンソン病の初期にαシヌクレインが過剰発現すると、軸索終末端のシナプス伝達機能に何らかの影響を与えることが考えられます。そこで我々は、αシヌクレインをラット脳切片の軸索終末端に注入して、小胞エンドサイトーシスやシナプス伝達にどのような影響があるのかを検討しました。
過剰なαシヌクレインは神経伝達を阻害する
軸索終末端の機能を測定するためには、ガラス管電極を用いたパッチクランプ記録法を行います。ガラス管の先端を細くのばして作った電極内には、神経細胞の細胞質成分を模した溶液(細胞内液)を充填しておき、導線(塩化銀コートされた銀線)をつなぎます。このガラス電極を軸索終末端に押しつけると、終末端の細胞膜がガラスに密着して、シールします。ここで陰圧をかけて細胞膜を破ることで、ガラス電極と終末端内とを物理的・電気的につなぎ、終末端の電気信号を記録することができます。この電気信号は非常に微弱なため、専用の増幅装置(パッチクランプアンプ)を用いて増幅し、パソコンに記録します。
小胞エンドサイトーシスの観察には、パッチクランプ法を応用した膜容量測定法を用います。細胞膜は電気的には、細胞内外の電解質溶液を仕切る絶縁体のため、コンデンサーとして働きます。コンデンサーは電荷を充放電する特性を持ち、その電気容量は絶縁体の面積に比例します。したがって、細胞膜面積の変化は電気容量(膜容量)の変化として記録されます。膜容量は、実際には、正弦波状の電位変化を細胞膜(軸索末端膜)に与え、測定される電流を専用の測定装置を通すことで記録します。
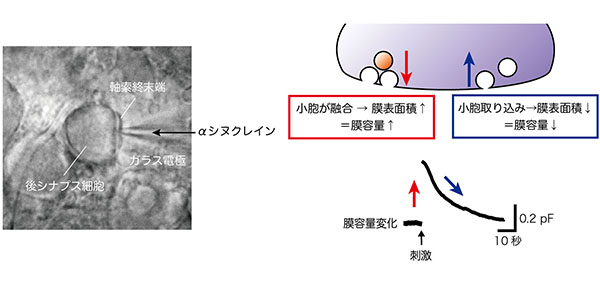
(右)マウス脳幹スライス上のシナプスからの記録の様子。中央の丸い部分が後シナプス細胞(台形体内側核神経)で、右に見える巨大軸索終末端(calyx of Heldシナプス)からガラス電極を用い電気記録を行っている。αシヌクレインはガラス電極を通して終末端内に注入した
(左)膜容量測定法の模式図。シナプス小胞が終末端膜に融合すると膜表面積が増え、膜容量も増える。融合した小胞が小胞エンドサイトーシスにより取り込まれると、膜表面積が減り膜容量も減る。膜容量測定法により膜容量の変化を測定し、小胞の融合・取込過程をモニターすることができる
αシヌクレインを数マイクロモル(μM)程度に細胞内液に溶かしてガラス電極に充填し、軸索終末端内に拡散注入すると、小胞エンドサイトーシスの速度が遅くなることがわかりました。小胞エンドサイトーシスの遅延はシナプス小胞の再利用を遅らせます。そのため、シナプス伝達が高頻度で長時間にわたる場合、シナプス伝達の精度が維持されなくなります。実際、αシヌクレインの軸索終末端内注入によってエンドサイトーシスが抑制されると共に、高頻度伝達の精度が損なわれることが明らかになりました。高頻度・高精度のシナプス伝達は知覚認知、記憶形成、運動制御などに関わることから、パーキンソン病の初期に軸索末端内のαシヌクレイン濃度が上昇すると、これらの神経機能が損なわれることが推定されます。
過剰αシヌクレインの毒性メカニズム
軸索末端内で増加したαシヌクレインは、どのように小胞エンドサイトーシスを阻害するのでしょうか。さらなる研究の結果、αシヌクレインが微小管の過剰形成を起こすことがわかりました。微小管は細胞骨格分子のひとつで、細胞の形を維持するだけでなく、細胞内小器官(ミトコンドリア、シナプス小胞など)の輸送路でもあります。我々は軸索末端内に微小管の形成を抑える薬物(ノコダゾールなど)を注入することで、過剰なαシヌクレインの小胞エンドサイトーシスや高頻度シナプス伝達に対する毒性を抑えることに成功しました。したがって、αシヌクレインによって微小管が軸索末端内で過剰に形成されることにより、小胞エンドサイトーシス機構が阻害されると考えられます。
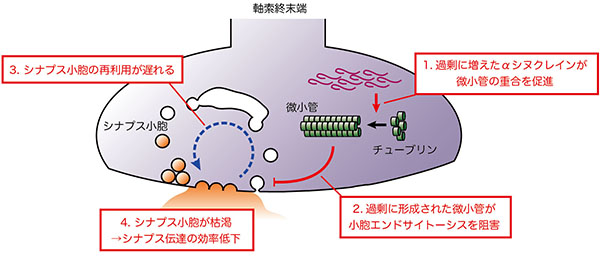
過剰なαシヌクレインは軸索終末端内での微小管の異常形成を引き起こし、これがシナプス小胞エンドサイトーシスを阻害する。小胞エンドサイトーシスの阻害はシナプス小胞の再生を遅らせ、結果高頻度シナプス伝達の効率が下がる
今後の展望
神経細胞内でのαシヌクレインの過剰発現は、パーキンソン病の初期段階に起こっていると考えられています。過剰なαシヌクレインはいずれ神経細胞を死に至らしめ、運動機能障害などの症状を引き起こします。そのため、現在、パーキンソン病の治療方法は、いかに神経細胞死を抑え、変性、死滅した神経細胞の機能をいかに補うかに傾注しています。今回、過剰発現したαシヌクレインは神経変性・細胞死に先立ってシナプス伝達機能に影響を及ぼすことが明らかとなりました。この研究成果を治療法の開発に結びつけるためには、αシヌクレインによる微小管の異常形成が小胞エンドサイトーシスを妨げるメカニズムを明らかにする必要があります。今回の研究で、パーキンソン病における過剰αシヌクレインの第一標的と、毒性メカニズムが明らかになったことは、新たな治療法の開発につながる成果と考えられます。
参考文献
Eguchi K, Taoufiq Z, Thorn-Seshold O, Trauner D, Hasegawa M, Takahashi T. (2017) Wild-type monomeric α-synuclein can impair vesicle endocytosis and synaptic fidelity via tubulin polymerization at the calyx of Held. J Neurosci 37(25): 6043-6052.
この記事を書いた人

-
江口工学(写真左)
IST Austria(オーストリア) ポスドク研究員。
2007年九州工業大学大学院博士後期課程修了。博士(情報工学)。2007年沖縄科学技術大学院大学(OIST)研究員、2017年より現職。シナプス伝達機構に関する研究に従事し、主にパッチクランプ法を用いた電気生理学実験を実施している。
高橋智幸(写真右)
沖縄科学技術大学院大学 Distinguished Professor (Fellow)
1975年東京医科歯科大学医学部大学院修了。医学博士。東京医科歯科大学、ロンドン大学、京都大学、東京大学を経て2007年より現職。2007年から2016年まで同志社大学大学院脳科学研究科を兼任。シナプス分子機能関連の研究に従事。




