アルツハイマー病の初期病態の回復可能性 – 実験モデルから推察できること
アルツハイマー病の脳に溜る異常タンパク質
アルツハイマー病(アルツハイマー型認知症)は認知症の原因疾患のなかで、最も患者数の多い疾患です。この病気の脳には細胞の外部(細胞間隙)に、アミロイドβタンパク質(Aβ)が線維化し、沈着しており、これは老人斑と呼ばれています。また、神経細胞の中では、細胞骨格を形造るタンパク質のひとつであるタウタンパク質(タウ)が異常に凝集、線維化して、神経原線維変化という異常構造物を形成します。これらはアルツハイマー病を特徴づける病変としてよく知られています。
Aβは、40~43個のアミノ酸からなる疎水性のペプチドです。約30年前に、Aβは、膜タンパク質であるアミロイド前駆体タンパク質から、タンパク分解酵素による切断によって産生されることがわかりました。そして、家族性アルツハイマー病の家系では、アミロイド前駆体タンパク質の遺伝子変異が発見されました。それ以降の研究の発展によって、Aβの蓄積がアルツハイマー病の発端になって、その後にタウの異常凝集、シナプスの異常、神経細胞死が起こり、病気が徐々に進行していくと考えられるようになりました。特に、タウやシナプスの異常変化は、神経細胞内の物質輸送、神経細胞間の情報伝達機構を障害することから、記憶障害などの認知機能異常が発現すると考えられます。
アルツハイマー病の病理変化は、発病のかなり前から始まっていると考えられています。最近では、脳内に溜っているAβを可視化する特殊な脳画像検査によって、Aβの蓄積はアルツハイマー病の発症の10年以上前から始まっていることが明らかになってきました。
アルツハイマー病の最近の研究から – 発症の鍵を握るAβオリゴマー
最近の研究から、Aβは線維化する前段階においては、オリゴマーという集合体を形成していて、このAβオリゴマーが神経細胞を障害する作用を持っていることがわかってきました。
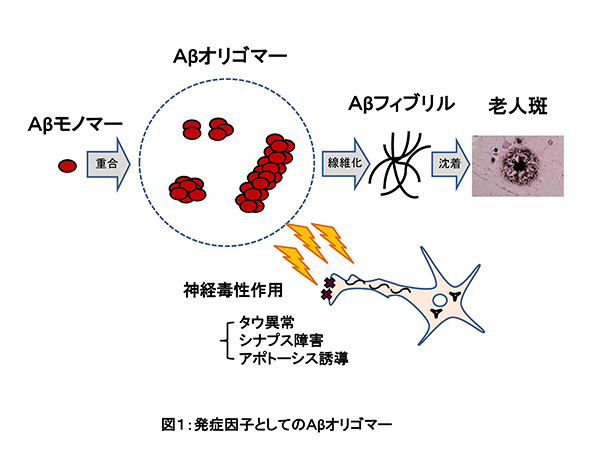
Aβオリゴマーには、集合している分子数によって、分子量の小さなものから大きなものまでさまざまなものが含まれています。また、アルツハイマー病患者の脳の中にも、これら種々のAβオリゴマーが存在していることがわかっていますが、このうち病気に特に関係するものがどれであるかなどははっきりしていません。
Aβオリゴマーは神経細胞にさまざまな悪影響ーータウの異常変化、シナプスの異常、細胞死の誘導などーーを及ぼします。タウが異常化すると、分子内の複数個所でリン酸化が亢進し、分子内切断も起こりますが、これらの変化によって神経原線維変化の形成が促進されると考えられています。このように、Aβオリゴマーによってアルツハイマー病の特徴的な病態が誘導されることから、Aβオリゴマーはアルツハイマー病の発症の引金として注目されるようになりました。
神経細胞の実験モデル
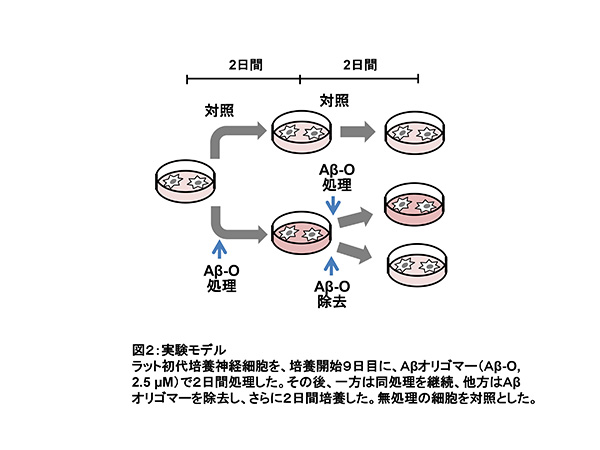
このAβオリゴマーの神経障害作用を詳しく研究するため、私たちは次のような実験モデルを作製しました。ラットの脳から分離した神経細胞を9日間培養したものに、調整したAβオリゴマーを添加すると、2日後には、細胞に異常が現れます。
この細胞の異常変化を、ウエスタンブロット法による解析や、特異的な抗体による免疫細胞染色などによって、詳しく調べました。その結果、1)アポトーシス(細胞死)誘導性の変化(カスパーゼ3の活性化など)、2)タウタンパク質の異常変化(リン酸化、分子内切断の増加など)、3)シナプスの形成・維持などに重要な役割を持つβカテニンの異常変化(タンパク質レベル低下、および局在異常)が見出されました。これらの変化はアルツハイマー病の脳で観察される病的変化の特徴と共通点があり、この実験モデルは、アルツハイマー病の病態を反映したものといえます。
Aβオリゴマーの神経毒性変化には可逆的性質がある
Aβオリゴマーの神経毒性については多数の研究が行われてきていますが、その毒性作用による細胞の障害性変化が可逆的なものなのかについてはよくわかっていませんでした。この問題を明らかにするため、図2のようにAβオリゴマーで2日間の処理を行った細胞を2群に分け、一方はAβオリゴマーを含まない培養液でさらに2日間培養し、もう一方はAβオリゴマー処理を2日間継続しました。
その結果、Aβオリゴマー処理を継続した細胞では、細胞死誘導性変化は増悪し、タウタンパク質、βカテニンの異常が持続しました。しかし、Aβオリゴマーを除去した細胞では、細胞死誘導性変化、タウタンパク質の異常が無処理の対照と同程度まで回復し、βカテニンの異常も部分的に回復しました。また、このβカテニンの異常にはシナプス構造の破綻が関連していることが示唆されました。
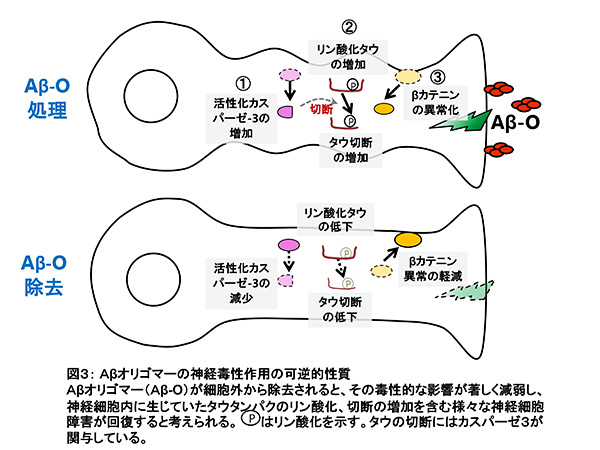
これらの実験結果は、Aβオリゴマーが主に細胞外から毒性作用を発揮していて、その結果生じる細胞内の障害性変化は可逆的なものであり、Aβオリゴマーを除くことにより回復可能なことを示唆しています。すなわち、神経細胞のモデル系において、Aβオリゴマーが神経細胞に引き起こすタウ異常などの様々な異常変化は、Aβオリゴマーの作用が除かれることで、回復しうることが初めて明らかとなりました。
アルツハイマー病の初期病態の回復可能性
以上の研究結果は、細胞モデルで得られたものではありますが、脳内の初期病態を間接的に反映していると考えられます。すなわち、病初期に何らかの手段によりAβオリゴマーを除くことができれば、病態が回復する可能性が推察されます。
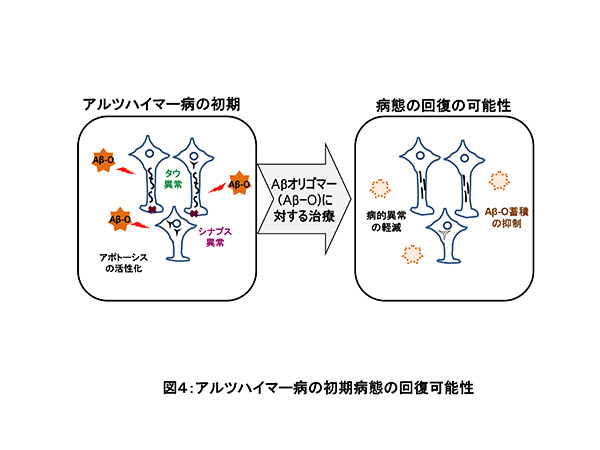
現在、実用化に向けて、Aβオリゴマーの蓄積に対する抑制作用を持つ薬剤の開発が進められています。たとえば、Aβオリゴマーに対する抗体療法や、Aβ産生酵素BACE1の阻害薬などがあげられます。アルツハイマー病では、タウの異常が顕在化してからでは治療が困難であると言われています。アルツハイマー型認知症の予備状態である軽度認知障害のような、できるだけ早期の段階で治療介入を行うことにより、アルツハイマー病態の進行を防ぐとともに、認知機能障害の回復を図ることができる可能性があると考えられます。
私たちは、Aβオリゴマーの蓄積を抑制する以外にも、Aβオリゴマーの毒性を低減することも治療につながると考えています。このAβオリゴマーの毒性作用メカニズムについては、細胞表面の何らかの受容体に作用し、異常シグナルを伝達するという仮説があるものの、いまだ明確ではありません。そこで、このAβオリゴマーに対する神経細胞の応答機序を解明するとともに、Aβオリゴマーの毒性作用を軽減するような新規薬剤を開発することを目指して、研究を進めています。
参考文献
1.Tanokashira D, Mamada N, Yamamoto F, Taniguchi K, Tamaoka A, Lakshmana MK, Araki W: The neurotoxicity of amyloid β-protein oligomers is reversible in a primary neuron model. Mol Brain 10:4, 2017
2.Mamada N, Tanokashira D, Hosaka A, Kametani F, Tamaoka A, Araki W: Amyloid β-protein oligomers upregulate the β-secretase, BACE1, through a post-translational mechanism involving its altered subcellular distribution in neurons. Mol Brain 8: 73, 2015
この記事を書いた人

-
国立研究開発法人 国立精神・神経医療研究センター神経研究所 疾病研究第6部 室長。京都大学医学部卒業。京都大学大学院修了(医博)。国立精神・神経センター神経研究所、マサチューセッツ工科大学(ポスドク研究員)を経て、現職に着任。専門分野は神経科学、神経内科学で、アルツハイマー病を含む神経変性認知症の研究をライフワークとしている。Current Neuropharmacology誌などの編集委員も務める。
研究室Webサイト




