光エネルギー変換の新常識! – 光駆動2価多原子アニオン輸送体の発見とその分光特性
生物と光
地球上の生物は、直接あるいは間接的に太陽光エネルギーを利用して生命活動を営んでいます。たとえば、植物は光合成システムにより光エネルギーから有機物や酸素を産生し、自身の成長に利用するとともに、他の生物の活動に必須の物質を供給しています。また、ヒトや微生物は光情報伝達システムを発達させ、外界からの情報の多くを光情報として得ています。このような光応答において、光受容を一義的に担うのが「光受容タンパク質」と呼ばれる分子です。
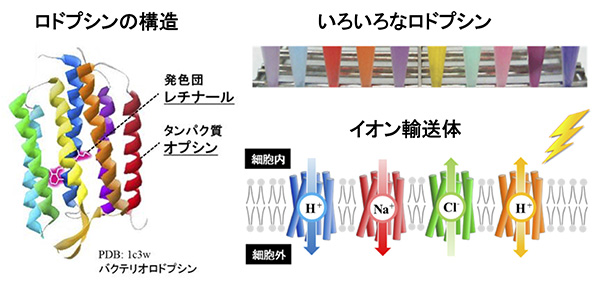
私たちの研究室では、光受容タンパク質のなかで巨大なグループを形成するロドプシン(レチナールタンパク質とも呼ばれる)と呼ばれる膜タンパク質に着目し、研究を行っています。ロドプシンは、ヒトなどの哺乳類から、細菌などの微生物に至るまで、幅広い生物種に存在することが知られており、さまざまな生物種の光応答に重要な役割を果たしていると考えられています。
ロドプシン – 光を感じるタンパク質
ロドプシンは、およそ300個のアミノ酸からなる比較的小型のタンパク質で、細胞膜を7回貫いたαヘリックス構造を有しています。一般的にタンパク質は透明であることが示すように、タンパク質が可視光を吸収するためには発色団と呼ばれる補助色素を必要とします。ロドプシンの場合にはビタミンAのアルデヒド型であるレチナールが補助色素であり、タンパク質部分(オプシン)の特定のリジン残基との共有結合により取り込まれています。
オプシンとレチナールの相互作用は、オプシンの種類により変化することから、ロドプシンは青色、紫色、赤色、黄色などの多彩な色を呈します。
このように、ロドプシンは小型かつ色で活性を判別できるという特徴から、光受容タンパク質のみならず膜タンパク質のモデルとして、古く(1870年代)から盛んに研究が行われています。
ロドプシンが光を受けると、発色団レチナールは数百フェムト秒(1フェムト秒 = 10-15秒)でトランスーシス異性化反応を起こし、これにより大きな正の自由エネルギー:ΔGを獲得します。このエネルギー変化が緩和する(ΔG < 0)過程で、タンパク質の構造変化が引き起こされ、ロドプシンの機能が発現します。このような性質はすべてのロドプシンで共通であるにも関わらず、ロドプシンが示す生理機能は、視覚応答、概日リズムの調整、イオン輸送、転写調節など極めて多様であることが、2000年以降のゲノム科学の進展に伴い明らかになってきました。2005年には、ロドプシンが示すイオン輸送能に着目し、神経活動を司る膜電位を光で操作する手法(オプトジェネティクス)が開発され、脳神経回路の解明や制御など、応用的な研究でも注目されています。
硫酸イオンを運ぶロドプシンの発見
イオン(H+, Na+, Mg2+, Ca2+, Cl–, SO42-など)は、正電荷を持ったカチオンと負電荷を持ったアニオンに分類され、それぞれ生物にとって必須の物質です。たとえば、カルシウムイオン(Ca2+)がないと骨はできませんし、血液中のカリウムイオン(K+)濃度が2倍になっただけで、心臓は停止してしまいます。また、医薬品の約16%がイオン輸送体をターゲットとしており、医薬品開発においても重要なターゲットです。
微生物界には、万を越えるロドプシンが分布しており、その代表的な機能は光エネルギーを使って細胞の内と外のイオンのやり取りを行うイオン輸送です。輸送の基質となるイオンは、1価のものかつ単原子のもの(H+, Na+, Cl–など)であるというのがこれまでの常識でした。これは、イオンが細胞膜という疎水的な環境を移動することを考えると理にかなっているように思われます。
科学研究では、“無い”ことの証明はほとんど不可能ですが、“ある”ことの証明は容易です。私たちは、ロドプシンの多様性を信じ、2価かつ多原子イオンである硫酸イオン(SO42-)を運ぶロドプシンを探索することにしました。そこで注目したのが、スイスの岩場に生息する真正細菌Synechocystis sp. PCC 7509です。この細菌は、硫酸イオンの豊富な環境中(推定数百mM程度)に生息しており、解読されたゲノムのなかにはロドプシンをコードすると推定される遺伝子がひとつ存在していました。そこで、この推定ロドプシン(Synechocystis Halorhodopsin, SyHRと命名)の遺伝子を化学的に全合成し、大腸菌に組み換え体として発現させました。さまざまなイオン条件下や化学試薬存在下で、この大腸菌に光を照射すると、溶液に硫酸イオンが含まれている場合に大きなイオン輸送能が観測されました。このことから、SyHRは光により細胞外から細胞内へ硫酸イオンを輸送するタンパク質であると結論付けました。つまり、これまでの常識を覆し、2価かつ多原子イオンを基質としうるロドプシンを見出すことに成功しました。
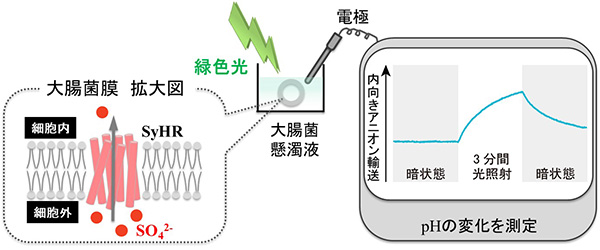
硫酸イオンの輸送メカニズム
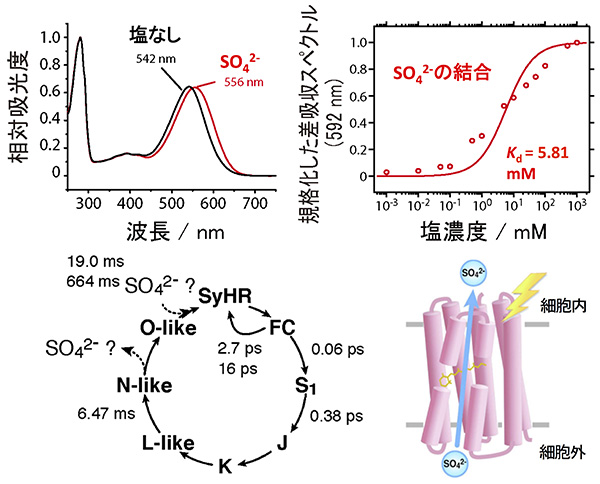
次に、さまざまな分光学的解析を行い光反応に伴うイオン輸送メカニズムを調べました。はじめに、硫酸イオンの濃度依存的なSyHRの色変化に着目し、硫酸イオンの結合力を見積もりました。すなわち、色変化量を硫酸イオン濃度に対してプロットし、それを1成分のヘンダーソン・ハッセルバルヒの式で回帰することで、解離定数Kdを求めました。その結果、硫酸イオンのKdは5.81mMと見積もられました。
この値はSyHRを持つ細菌が生息する生理環境よりも2桁程度小さな値であり、生理環境中のSyHRには硫酸イオンが結合していることが推測されました。次に光照射後の硫酸イオン輸送過程を調べるために、フェムト秒〜秒の時間スケールで光反応解析を行いました。その結果、光照射後にいくつかの中間体を経て、約1秒かけてもとの状態に戻る光サイクル反応を示すこと、硫酸イオンは光反応の後半で出入りすること、などが明らかとなりました。
これらの結果に基づき、私たちはSyHRの硫酸イオン輸送メカニズムを提案しました。現段階では光により硫酸イオンを細胞内に取り込む生理的意義は不明ですが、SyHRを持つ細菌が硫酸イオンの豊富な環境に生息していることから、何らかの意味があるものと考えています。
今後の展開
SyHRは硫酸イオンを輸送するという、これまでに類をみないまったく新しい性質を示しました。今後は、SyHRの2価アニオンの輸送メカニズムのさらなる解明に取り組み、将来的には、その性質を活かした応用研究にもつなげていきたいと考えています。具体的には、硫酸イオンは生体内において薬物代謝などに利用される主要なイオンのひとつでありながら、その役割は未だ詳細がわかっていません。生体内の硫酸イオンを光によって人為的に制御することができれば、その役割を解明するための一役を担うことができるかもしれません。また、SyHRには、基質イオンの結合の有無を色の変化でとらえることができ、かつ低濃度でも検出できるという特徴があります。その性質を活かし、環境中における硫酸イオン濃度を測定するバイオマーカーとして活用できるのではないかと考えています。
参考文献
Niho A, Yoshizawa S, Tsukamoto T, Kurihara M, Tahara S, Nakajima Y, Mizuno M, Kuramochi H, Tahara T, Mizutani Y, & *Sudo Y. “Demonstration of a light-driven SO42- transporter and its spectroscopic characteristics” (2017) Journal of the American Chemical Society, 139, 4376-4389.
Inoue K, Tsukamoto T, Shimono K, Suzuki Y, Miyauchi S, Hayashi S, Kandori H, & *Sudo Y. “Converting a light-driven proton pump into a light-gated proton channel” (2015) Journal of the American Chemical Society, 137, 3291-3299.
Kanehara K, Yoshizawa S, Tsukamoto T, & *Sudo Y. “A phylogenetically distinctive and extremely heat stable light-driven proton pump from the eubacterium Rubrobacter xylanophilus DSM 9941T” (2017) Scientific Reports, 7, 44427.
この記事を書いた人

-
仁保亜紀子(写真左)
岡山大学薬学部6年生。大学3年生から現在の研究室に所属し、ロドプシンの研究を行っています。創薬研究には化学や生物、薬理など様々な視点からのアプローチが必要とされますが、その中で私たちは光に注目した創薬研究に取り組んでいます。現在はまだ基礎研究の段階ですが、「光を薬にかえる」という当研究室のコンセプトに惹かれた一人として、将来的に医療分野へ応用されることを目指しています。
須藤雄気(写真右)
2005年北海道大学大学院薬学研究科修了:博士(薬学)。2005年テキサス大学ヒューストン校ポスドク、2007年名古屋大学大学院理学研究科助教、2009年同准教授を経て、2014年4月より岡山大学大学院医歯薬学総合研究科(薬学系)教授。一貫して「光を薬へ」をキーワードにロドプシンの探索・解析・操作の研究を行っています。




