【特別寄稿】乾いても死なないクマムシの謎。その鍵を握るのは……?
よく聞かれる質問の中に「どうしてクマムシを研究しはじめたんですか?」というものがある。「そのクマムシ帽子はどうやって頭にくっついているんですか?」の次に、頻繁に聞かれる質問である。
クマムシの道に入ったのは、私が大学学部4年生のとき。変わり者だった教授に興味を持ち、その研究室に入ったのがきっかけである。その教授、関邦博さんは「クマムシの超高圧耐性」を初めて発見した人だった。ある日、研究室OBの豊島正人さんが私にクマムシを見せてくれた。
クマムシは可愛かった。
豊島さんは、その可愛いクマムシを乾燥させた。水を失ったクマムシは、空き缶が潰れたような姿になり、まったく動かなかった。だが、水をかけてからしばらくすると徐々に動き始めた。信じられない光景だった。
「可愛くて、強い」。これが、私がクマムシに惹かれた理由だ。
今回は、このクマムシの「強さ」に焦点を当てて論じたい。クマムシは乾燥しても死なず、吸水すると復活できる。この乾燥した仮死状態を、乾眠という。
クマムシは乾眠になると、超低温、超真空、超高圧などの極限環境に耐えることができる最強モードになる。クマムシは乾眠に移行するとき、体内の水分が80%から3%以下にまで低下する。カチカチの鰹節でも、15%ほどの水分がある。クマムシがいかにカラカラかがわかるだろう。当然ながら、私たちがこんなふうにカラカラになってしまえば、水を吸ったとしても生き返ることはない。
通常、細胞から水がなくなると、細胞膜が壊れたり、タンパク質などの生体物質の構造が崩れてしまう。いったんそうなると、水が与えられても、元に戻ることはない。つまり、生命活動が再開せず、死んでしまう。
クマムシは動物であり、多細胞生物である。我々と同じように神経や筋肉といった組織をもつ。つまり、乾眠のクマムシ体内ではこれらの組織もカラカラになっているが、何らかのしくみで壊れないように守られているわけだ。カラカラになっても乾眠になって生き延びられるクマムシには、極端な乾燥ストレスから細胞を守る仕組みがあるはずだ。
クマムシの細胞を守る実体として最初に提唱された物質が、二糖類のトレハロースである。センチュウやネムリユスリカなどクマムシと同様に乾眠する動物では、乾眠時にこのトレハロースが体重の15〜20%ほど蓄積されることが知られていた(1)。
トレハロースは乾燥した細胞の中で水の代わりに生体分子と相互作用したり(2)、ガラス化とよばれる状態を作り出し細胞の構造を保持する働きがあると考えられている(3)。クマムシの一種カザリヅメクマムシ(Richtersius coronifer)でも、乾眠移行に伴ってトレハロース蓄積量が20倍以上になることから、やはりクマムシの乾眠にもトレハロースが重要な働きをもつものと思われた(4)。
だが、カザリヅメクマムシでは乾眠時のトレハロース蓄積量が体重の2%ほどと比較的少ない。さらに、トレハロースを全く蓄積しないクマムシの種類も見つかり(5)、「トレハロース説」はクマムシの乾眠メカニズムをうまく説明できないことがわかってきた。
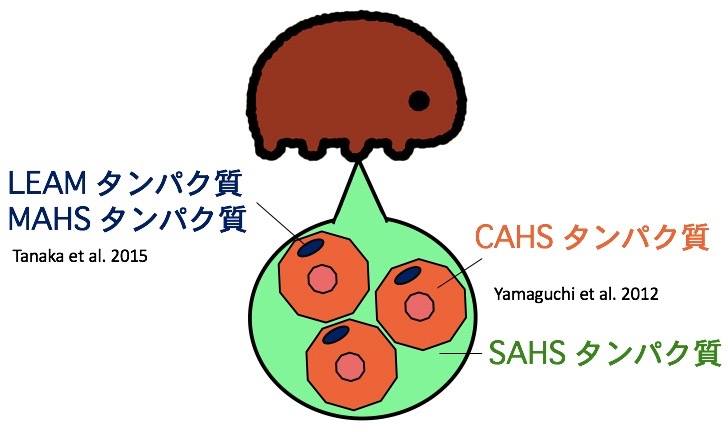
時が経ち2010年代に入ると、我々が飼育実験系を確立したヨコヅナクマムシ(Ramazzottius varieornatus)(6)をはじめとした数種のクマムシのゲノム解析が進み、クマムシの乾眠メカニズムを解析するための分子基盤が整備されてきた。そして2012年、クマムシに特異的なタンパク質であるCAHS(Cytoplasmic Abundant Heat Soluble)タンパク質とSAHS(Secretory Abundant Heat Soluble)タンパク質が、ヨコヅナクマムシから見つかった(7)。
通常、タンパク質は熱すると凝集してしまうが、CAHSタンパク質とSAHSタンパク質は高温でも凝集しない。水に溶ける能力(親水性)がきわめて高い特徴がある。これらのタンパク質は水に溶けている時は決まった立体構造をとらないが、乾燥するとコイル状の構造(αヘリックス構造)をとり、細胞内外の生体分子と相互作用することで乾燥した細胞を保護しているのではないかと考えられた。
さらに、ヨコヅナクマムシには細胞のミトコンドリアに局在するLEAMタンパク質とMAHSタンパク質も確認された(8)。これらもクマムシ以外の生物では見つかっていなかったタンパク質であり、乾燥した際にミトコンドリアの構造を保つ働きがあると推測される。
クマムシ特異的に見られるこれらのタンパク質は、乾眠に重要な働きをもつと思われるが、「確実にそうだ」とは断言できない。クマムシの遺伝子の働きを抑えるなどしてこれらのタンパク質の合成を抑えたときに、クマムシが乾眠に入れなくなったときにようやく、これらのタンパク質がクマムシの乾眠メカニズムにかかわっていることを主張できるからである。また、この主張をするためには、クマムシのこれらのタンパク質をコードする遺伝子を他の生物や細胞に入れたとき、乾燥耐性の向上を確認するのも一つの手だ。
クマムシの遺伝子操作は長い間確立されてこなかったが、2013年にノースカロライナ大学の研究グループがドゥジャルダンヤマクマムシ(Hypsibius dujardini)にRNA干渉法を適用できることを示した(9)。RNA干渉法は、短い二本鎖RNAを細胞内に送り込み、遺伝子の転写産物であるmRNAに干渉し、目的のタンパク質を作らせなくする技術であり、発見者のFire博士とMello博士は 2006年にノーベル生理学・医学賞を受賞している。
2017年、ノースカロライナ大学のグループは、ドゥジャルダンヤマクマムシの2つのCAHSタンパク質遺伝子と1つのSAHSタンパク質遺伝子の発現を抑制すると、乾燥耐性が有意に低下することを報告した(10)。さらにこのグループは、複数あるCAHSタンパク質遺伝子のうちのいくつかを大腸菌や酵母に入れ、乾燥耐性を向上させることにも成功した。
これら実験結果から、これらのタンパク質が、ドゥジャルダンヤマクマムシの乾燥耐性獲得に関わっていることが示されたのである。ただし、この研究報告ではRNA干渉法によりクマムシの遺伝子発現が実際に抑えられているかを確認していなかったりと、データの妥当性に不十分な点もある。
今後、CAHSタンパク質やSAHSタンパク質をはじめとしたクマムシの乾眠関連候補因子の働きを知るために、私はクマムシでのゲノム編集技術CRISPR/Cas9法を確立し、解析を進めていく予定だ。RNA干渉法ではターゲットの遺伝子の発現を完全には抑制できないし、その抑制も一過性のものだ。その一方で、ゲノム編集技術では標的の遺伝子を破壊できるため、遺伝子の働きを完全に失わせることができると期待される。
クマムシにおけるゲノム編集技術応用の報告はまだないため、この技術の確立は一から進めていかなければならないが、クラウドファンディング(※)支援を生かしてぜひとも確立させ、「乾いても死なない」クマムシの強さの謎を少しでも解明していきたい。
※クラウドファンディング「最強生物クマムシの耐性の謎をゲノム編集で解明する!」は5月19日19:00まで支援を受け付けています。
参考文献
- Watanabe M (2006) Anhydrobiosis in invertebrates. Applied Entomology and Zoology 41: 15-31.
- Crowe JH, Carpenter JF, Crowe LM (1998) The role of vitrification in anhydrobiosis. Annual Review of Physiology 60: 73-103.
- Sakurai M, Furuki T, Akao KI, Tanaka D, Nakahara Y, Kikawada T, Watanabe M, Okuda T. (2008) Vitrification is essential for anhydrobiosis in an African chironomid, Polypedilum vanderplanki. 105: 5093–5098.
- Westh P, Ramløv H (1991) Trehalose accumulation in the tardigrade Adorybiotus coronifer during anhydrobiosis. Journal of Experimental Zoology 258: 303-311.
- Hengherr S, Heyer AG, Koehler HR, Schill RO (2008) Trehalose and anhydrobiosis in tardigrades — evidence for divergence in responses to dehydration. FEBS Journal 275:281-288.
- Horikawa DD, Kunieda T, Abe W, Watanabe M, Nakahara Y, Yukuhiro F, SakashitaT, Hamada N, Wada S, Funayama T, Katagiri C, Kobayashi Y, Higashi S, Okuda T (2008) Establishment of a rearing system of the extremotolerant tardigrade Ramazzottius varieornatus: a new model animal of astrobiology. Astrobiology 8: 549-556.
- Yamaguchi A, Tanaka S, Yamaguchi S, Kuwahara H, Takamura C, Imajoh-Ohmi S, Horikawa DD, Toyoda A, Katayama T, Arakawa K, Fujiyama A, Kubo T, Kunieda T (2012) Two novel heat-soluble protein families abundantly expressed in an anhydrobiotic tardigrade. PLoS One 7: e44209.
- Tanaka S, Tanaka J, Miwa Y, Horikawa DD, Katayama T, Arakawa K, Toyoda A, Kubo T, Kunieda T (2015) Novel mitochondria-targeted heat-soluble proteins identified in the anhydrobiotic tardigrade improve osmotic tolerance of human cells. PLoS One 10: e0118272.
- Tenlen JR, McCaskill S, Goldstein B (2013) RNA interference can be used to disrupt gene function in tardigrades. Development Genes and Evolution 223: 171-181.
- Boothby T, Tapia H, Brozena AH, Piszkiewicz S, Smith AE, Giovannini I, Rebecchi L, Pielak GJ, Koshland D, Goldstein B (2017) Tardigrades use intrinsically disordered proteins to survive desiccation. Molecular Cell 65:975-984.
この記事を書いた人

- クマムシ研究歴16年のクマムシ博士。クマムシの極限環境耐性に関する研究を一貫して行ってきた。NASAなどでクマムシの研究を遂行したのち、パリ第5大学を経て、現在は慶應義塾大学先端生命科学研究所特任講師および政策・メディア研究科特任講師(非常勤)。著書に『クマムシ博士の最強生物学講座』、『クマムシ研究日誌』、『クマムシ博士のクマムシへんてこ最強伝説』がある。慶応義塾大先端生命科学研究所の荒川和晴准教授らと連携を行いながらクマムシ研究の拡大に努めている。
この投稿者の最近の記事
 研究成果2017年5月18日【特別寄稿】乾いても死なないクマムシの謎。その鍵を握るのは……?
研究成果2017年5月18日【特別寄稿】乾いても死なないクマムシの謎。その鍵を握るのは……?



