セレン原子が切り開く、インスリン化学合成と機能の向上を目指した新しい道筋
インスリン製剤の現状
糖尿病患者の数は世界で4億人を超えるといわれています。インスリン製剤は患者の命をつなぐ唯一の薬剤である一方で、高頻度での製剤の皮下投与は患者の肉体的、精神的、そして経済的な負担が大きいものです。したがって、インスリンのより安価な市場供給を可能にする新しい製造法を確立することや、投与頻度を抑えることができるような新規製剤の開発が、創薬分野における喫緊の課題となっています。
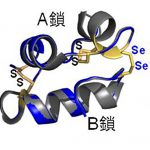
インスリンはA鎖とB鎖の2本のペプチド鎖からなるタンパク質で、鎖間はシステイン(Cys;C)残基間で形成される2組のジスルフィド(S-S)結合によってリンクされた構造をとっています。一般的に広く認知されるインスリンですが、そのユニークな構造から、人工調製は実は容易ではありません。
現在では酵母や大腸菌による発現系を基盤とした遺伝子工学技術が応用されており、A鎖とB鎖がリンカー(C-ペプチド)で繋がったプロインスリンを発現し(Step 1)、S-S結合を架橋後(Step 2)、C-ペプチドを酵素によって切除(Step 3)する多段階な工程を踏む必要があります。
この手法では、(1)Step 1が生物の力に依存するため非天然アミノ酸を導入することが困難で、新規製剤の分子設計を大きく制約する、(2)Step 2においてでたらめにS-S架橋した種が生じる、(3)Step 3において目的部位以外でのペプチドの切断が起こる、など多くの問題を孕んでいるのが現状です。
温故知新 – 最古の手法から学ぶインスリン合成の新手法
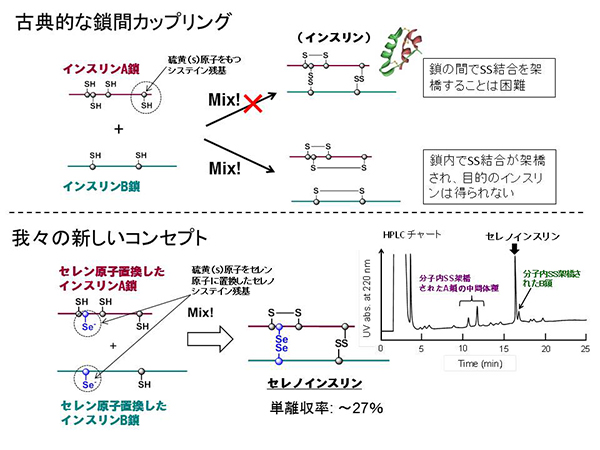
「このような多段階的なインスリンの調製方法をもっと簡便にできないだろうか?」インスリンを構成するA鎖とB鎖を合成し、溶液内で混ぜるだけで目的のインスリンを得ることができればこれほど簡単な方法はありません。このような手法はすでに、60年も前に考案され、さまざまな研究グループが試行錯誤を繰り返しましたが、結局はA鎖とB鎖の分子内でS-S結合が優先的に架橋されてしまうため、目的のインスリンはほとんど得られない(収率は約1~5%ほど)と結論付けられました。
しかし、我々はあえて原点回帰し、この歴史に埋もれたコンセプトを採用しました。この古典的な手法を現代の効率的なインスリン合成法へと昇華させるため、反応性に富むセレン(Se)原子に着目しました。つまり鎖間架橋を作る硫黄(S)をSeに置き換えたA鎖とB鎖を用いれば、鎖間でジセレニド(Se-Se)結合が迅速に形成され、両ペプチド鎖の会合反応を効率的に行えると予想しました。
実際、Cys残基のSをSe原子に置換したセレノシステイン(Sec;U)を組み込んだA鎖とB鎖を合成し、各ペプチド鎖を最適な条件下で混合させることで、目的のセレン含有インスリン、名付けて「セレノインスリン」が最大27%の単離収率で得られました。セレンを導入する戦略は、予想どおり、二本鎖のインスリン構成鎖を用いた古典的な手法を改善しました。
「セレノインスリン」の特徴
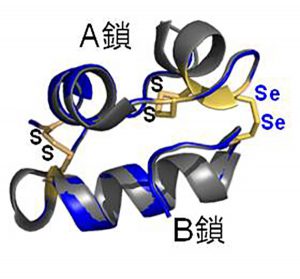
セレン原子導入という人工的な改良を施している以上、セレノインスリンの特徴を構造と生理活性の両面から把握する必要があります。はじめに、X線結晶構造解析によってセレノインスリンの3次元構造の解明に取り組みました。分析の結果、セレノインスリンは天然のインスリン同様の立体構造を有していることがわかりました。
さらに、セレノインスリンによる細胞刺激応答を観測し、その生理活性を評価しました。インスリンによる細胞刺激では、細胞表面のインスリンレセプターからリン酸化シグナル伝達を引き起こすことが知られています。天然のインスリンとセレノインスリンを用いて細胞刺激を行い、AktとGSK3bというタンパク質のリン酸化状態を比較することで、セレノインスリンの生理活性を評価することができます。結果として、セレノインスリンは“インスリン”としての生理機能を保持していることを確認することができました。
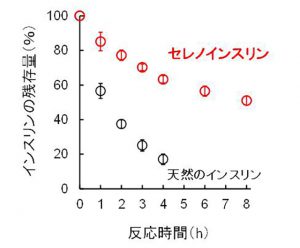
一方で、セレノインスリンは天然インスリンよりもインスリン分解酵素(IDE)に対して高い耐性を持つことが、試験管内でのIDEによる分解実験から明らかになりました。これはSe-Se結合自身の強固な安定性に加えて、IDEが認識しているインスリンの局所構造がセレノインスリンではごくわずかに変形していることに起因しているものと考えられます。
次世代インスリン製剤の開発を目指して
皮下注射されたインスリン製剤は、血流によって循環した後、最終的に腎臓内のIDEによって分解され体外に排出されます。腎不全を併発した糖尿病患者は一般的にインスリン製剤の投与量・回数が減少しますが、これは皮肉にも腎臓内でのインスリン分解が滞り、血中のインスリン濃度が低下しにくくなるためであると考えられます。
もしIDEに対して分解耐性を示すインスリンができれば、長時間にわたって体内を循環し、投与頻度を抑えることができる新しいタイプの薬効持続型(持効型)インスリン製剤の開発につながるかもしれません。我々の研究グループでは上記で述べたようにセレノインスリンが顕著なIDE耐性を示すことを見出しており、化学合成を基盤とした新しいインスリン製剤開発の扉を開きつつあると考えています。
セレン原子は我々の体の中にも存在する必須微量元素で、それを含むセレノシステイン(Sec)はさまざまな酵素(特に抗酸化酵素)の構成アミノ酸として存在しています。しかし、インスリンにSecを導入した際の毒性や、IDE分解耐性が動物においてどのような影響を与えるか慎重に検討する必要があると考えています。動物実験と分子構造の最適化を行い、将来的にはセレノインスリンが糖尿病患者の投薬負担を軽減する新規製剤として利用されることに期待したいです。
参考文献
Kjeldsen, T. Yeast secretory expression of insulin precursors. Appl. Microbiol. Biotechnol. 54, 277–286 (2000)
E. Liu, et al., Chemical synthesis of peptides within the insulin superfamily. J. Pept. Sci. 22, 260–270 (2016).
K. Arai, et al., Preparation of Selenoinsulin as a Long-Lasting Insulin Analogue, Angew. Chem. Int. Ed., 56, (2017), in press.
この記事を書いた人

- 東海大学理学部化学科講師(2017年4月より)/東海大学大学院総合理工学研究科博士後期課程早期修了。博士(理学)。2012年東海大学理学部化学科 日本学術振興会特別研究員PD、2013年イギリス カーディフ大学博士研究員、2014年東海大学理学部化学科助教を経て現職。タンパク質の構造・物性・フォールディング研究および有機セレン分子の合成研究を基軸としながら、薬剤の新しい構造モチーフの探索などを進めています。