細胞膜内に存在する機能領域「ラフト」の正体に迫る
細胞膜はどのような構造をしているのでしょうか? 地球上のすべての細胞の細胞膜は2次元の液体です。細胞膜は、脂質とタンパク質からできていて、それらの分子は細胞膜の2次元液体中で熱運動して動き回っています。1972年に提案されたSinger-Nicholsonの流動モザイクモデルでは、細胞膜は一様な構造と想定されていました。しかし、細胞膜の詳細な構造が明らかになるにつれ、この描像は改訂され続けています。そのなかでも、20世紀後半に提唱されたラフトモデルは、とりわけ多くの研究者の注目を集めています。
ラフトとは筏のことです。このモデルでは、液体の細胞膜中に特定の脂質(スフィンゴミエリンやコレステロールなど)とタンパク質(GPIアンカー型受容体など)が集合した領域(ラフト)が浮かんでいることが提唱されています。
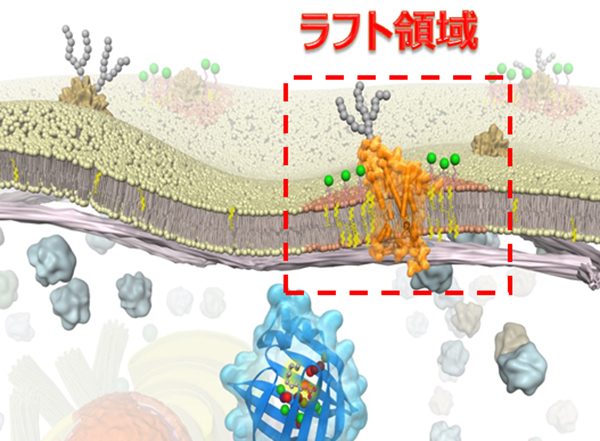
比喩的には、不飽和脂肪酸の多いオリーブオイルの海の上を、コレステロールや飽和脂肪酸に富んだバターの筏が漂っている、といったところです。近年、細胞膜上での信号伝達や細胞分裂、ウイルス感染などさまざまな生体現象に、ラフトが必要であることが示唆されるようになり、ラフトは幅広い分野で注目を集めています。一方、実際のデータは、「何か変わったことが起こっているらしい」ことを示すばかりで、ラフトは、「予想外の結果を解釈するためのひとつの仮定」でしかありませんでした。すなわち、ラフトは、多くの研究者の努力にかかわらず、生きた細胞の細胞膜では検出できていません。
なぜラフトの検出は難しいのか
では、なぜラフトの検出が難しいのでしょうか? 2つの問題がありました。ひとつは、ラフトを構成する脂質分子の振る舞いを観察する方法がなかったことです。脂質がラフトを作る様子を観察するには、ラフトに集まりそうな脂質に蛍光物質で目印を付け、その脂質の動きを顕微鏡で観察することが最も直接的です。しかし、巨大な蛍光性分子を脂質に結合させることで、脂質の性質や細胞膜の構造も変わってしまいます。
もうひとつの原因は、今回我々が報告したように、ラフトが極めて小さく、また、短寿命であることが挙げられます。本研究では、ラフトの形成に重要だと考えられているスフィンゴミエリンというリン脂質の一種に注目し、以下の3つを目的として、検討を行いました。
(1) スフィンゴミエリンや対照となるホスファチジルコリンを、生細胞の細胞膜中で分子1個ずつの単位で、可視化する方法を開発する。
(2) スフィンゴミエリンと同様に、ラフトに集まることが知られているGPIアンカー型受容体(CD59)の相互作用(どのように結合、解離するか)を明らかにし、さらにラフト形成に必須であると過程されているコレステロールの関与を解明する。
(3) (1)と(2)の研究によって、生細胞の細胞膜中でラフトを検出し、物性と機能を解明する。
蛍光標識されたスフィンゴミエリン、ホスファチジルコリンの合成
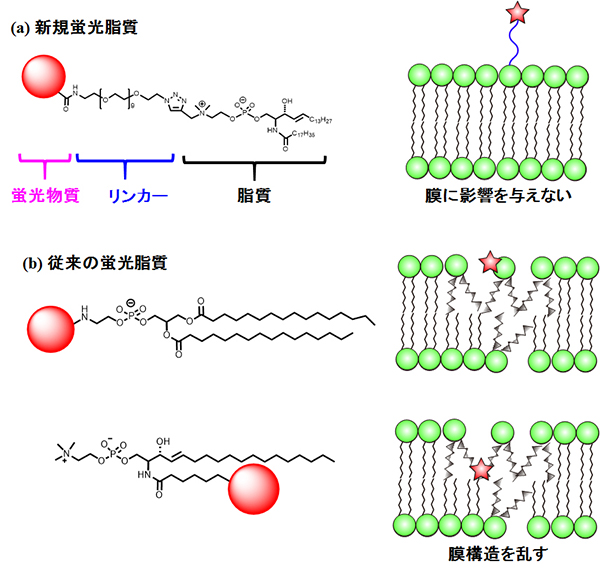
まず、我々は、スフィンゴミエリンなどのリン脂質本来の性質を変えることなく蛍光分子を結合させた蛍光脂質アナログを開発しました。この研究は大阪大学JST-ERATO脂質活性構造プロジェクトにおいて行われたものです。下図に示したのは、従来のスフィンゴミエリンの蛍光アナログ分子と新たに合成した蛍光アナログ分子の違いです。従来型とは違い、新規アナログでは、親水性の蛍光分子(目印にする部分)を用い、蛍光分子とスフィンゴミエリン分子の間に長い親水性の鎖(リンカー)をはさみ、さらに、元の分子が持つ電荷を維持することで、目印の蛍光分子が細胞膜に近づくことができないように設計してあります。この設計により、スフィンゴミエリンや細胞膜に対する蛍光分子の影響を小さくすることができます。
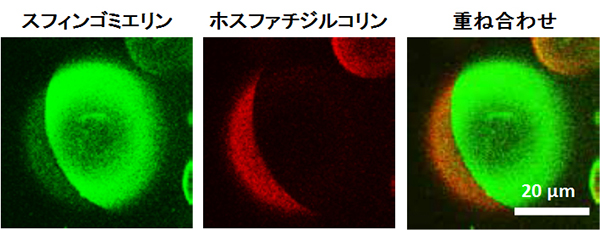
実際、我々はスフィンゴミエリンと、ラフト外に多く存在する対照分子のリン脂質ホスファチジルコリンに蛍光化合物を同じ方法で結合させ、人工的に作製したラフト様領域を含む膜で分布を観察してみました。その結果、膜中で両者は互いに隔てた異なる場所に分布することがわかりました。
スフィンゴミエリンはCD59やコレステロールとどのように相互作用しているか
以前、京都大学iCeMSの楠見明弘教授、鈴木健一准教授らは、1分子観察によって、ラフトに親和性があるとされているGPIアンカー型受容体と呼ばれる一群の特殊な構造を持つ受容体(CD59)は、コレステロールと結合することによって、寿命が約0.2秒の二量体(CD59が2つ集まった構造)を形成することを明らかにしました。また、受容体に細胞外からの刺激分子(補体複合体やC9という分子)がCD59に結合すると、今度は、安定な四量体(コレステロールを含む)を形成することも示しました。それまで、ラフトは直径が1μm(= 1/1,000mm)もあるような、非常に大きな構造であると思っている人も多くいました(細胞の大きさは、直径が数十μm)。しかし、楠見教授らの2012年の発表では、CD59の二量体+コレステロールの大きさは数nmしかないことや、ラフトの寿命は1秒未満であることを明らかにしました。
そこで、今回の実験では、楠見教授らとの共同で、もうひとつのラフト形成の主役であるスフィンゴミエリンがCD59やコレステロールとどのように相互作用しているかを調べました。本研究の場合、CD59は、上記のように、単量体、二量体、四量体と、さまざまな形態をとります。それらとスフィンゴミエリンとの結合を調べた結果、結合時間は、それぞれ、16ミリ秒、33ミリ秒、50ミリ秒であることがわかりました。つまり、スフィンゴミエリンは、複数の分子が次々と交替でCD59に結合してきて、各分子は、非常に短時間しかCD59には結合していないことがわかりました。
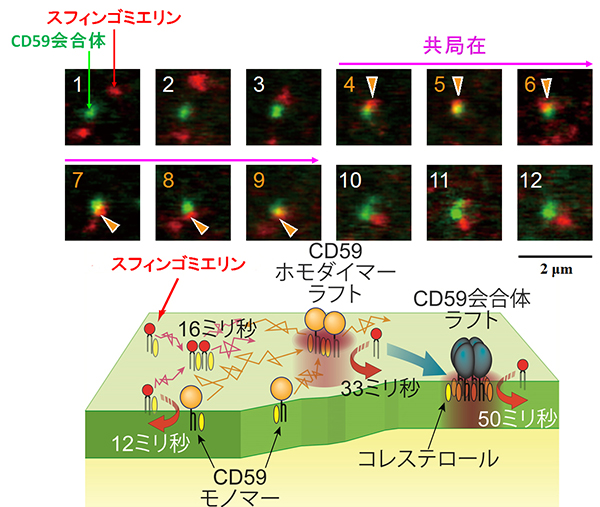
今回の実験で、ラフトを作ると思われていた分子同士(スフィンゴミエリンとCD59)が結合すること、それにはコレステロールが必要であることがわかりました。すなわち、ラフトを作る3役者がそろい踏みで集合体を作ることがわかりました。これが探していたラフトの正体であると考えられます。今までは、生細胞の細胞膜中で、安定で大きなラフト領域を探していたので見つからなかったのです。本研究によって、ラフトの大きさはせいぜい数ナノメートル、さらに、長くとも0.2秒程度で崩壊し、スフィンゴミエリンは、10〜50ミリ秒程度で入れ替わるような、極めて過渡的な分子集合体であることがわかりました。
細胞膜中にある超過渡的ラフトナノドメインの物性と機能
今回行った新たな研究結果と、以前の研究結果を合わせると、ラフトの正体は以下のようであることがわかりました。
(1) 細胞外からCD59へのシグナルが来る前;CD59は単量体(単量体が関わるラフト領域)と二量体を中心とするラフト領域という2つの状態間で、常に転換していました。また、二量体ラフトの寿命は200ミリ秒程度でした。このようなラフトができるにはコレステロールが必要で、コレステロールはCD59が集まるための必須アイテムです(これは、京都大学楠見教授らの
(2) (1) の刺激前の細胞膜;CD59の単量体と二量体が関わるラフトに、スフィンゴミエリンは過渡的にやってきました。また、滞在時間はそれぞれ16ミリ秒と33ミリ秒であり、CD59とスフィンゴミエリンの集合にはコレステロールが必要でした。したがって、CD59+スフィンゴミエリン+コレステロールでラフトができます。スフィンゴミエリンの滞在時間は短く、複数のスフィンゴミエリンが次々にCD59ラフトドメインにやってきては、すぐに、ラフト外にいる分子と入れ替わることがわかりました。
(3) 細胞外からCD59に刺激が入ったあと;CD59は主に四量体を中心とするラフトを形成しました。そこにスフィンゴミエリンがリクルートされて来ました。滞在時間は50ミリ秒と、やはりとても短いものでした。
(4) すなわち、本研究で、初めてラフトが生細胞中の細胞膜で観察できたといえます。大きさは数nmであり、スフィンゴミエリンはきわめて動的に出入りします。滞在時間は10~48ミリ秒。すなわち、ラフトドメインは極めて動的な構造であることがわかりました。
今後の期待
生体内にはおよそ数千種類もの脂質が存在しており、それぞれの脂質が異なる役割を担っています。それゆえ、脂質は生命科学最後のフロンティアといわれ、生体内における脂質の分布や挙動の可視化技術は幅広い分野で期待されています。本研究では、とくにスフィンゴミエリンとホスファチジルコリンの可視化に注目しました。スフィンゴミエリンは、細胞膜の主要な構成成分であり、代表的なラフト脂質ですが、その局在や機能はわからない点が多いです。
今回、本研究グループが開発したスフィンゴミエリン蛍光アナログによって、ラフトドメイン形成機構が明らかになると期待されます。さらには、スフィンゴミエリンは、その蓄積により発症するニーマン・ピック病や無βリポタンパク質血症など、その代謝異常が多くの疾病の原因になるとされています。本研究で開発された蛍光標識スフィンゴミエリンは、疾病の発症解明のための大きな一歩であるばかりでなく、疾病を阻止する薬剤開発にも寄与するもので、今後解明が進むことが期待されます。
参考文献
Kinoshita and Suzuki et al., 2017. J. Cell Biol. 216, 1183-1204.
Suzuki et al., 2012. Nat. Chem. Biol. 8, 774-783.
特許; 新規蛍光標識スフィンゴミエリンとその利用 (国内)2015-052518, (国際) PCT/JP2016/58079
この記事を書いた人

- 私は、関西学院大学において生物物理学、とりわけ、脂質膜の構造や物性について学びました。その後、大阪大学JST-ERATO脂質活性構造プロジェクトにおいて、脂質膜中で生じる相分離(ラフト)に関する研究をおこないました。その後、九州大学理学研究院生体分析化学研究室助教に着任。 現在は、共焦点レーザー顕微鏡、凍結割断電子顕微鏡法、熱測定、Langmuir-Blodgett法、小角X線散乱法などを用いて、生体膜や細胞膜の研究に取り組んでいます。また、新しい測定手法の開発にも着手しています。
この投稿者の最近の記事
 研究成果2017年4月25日細胞膜内に存在する機能領域「ラフト」の正体に迫る
研究成果2017年4月25日細胞膜内に存在する機能領域「ラフト」の正体に迫る



