「細胞質流動」の再現に成功! – 人工細胞を作って、細胞の仕組みを解明する
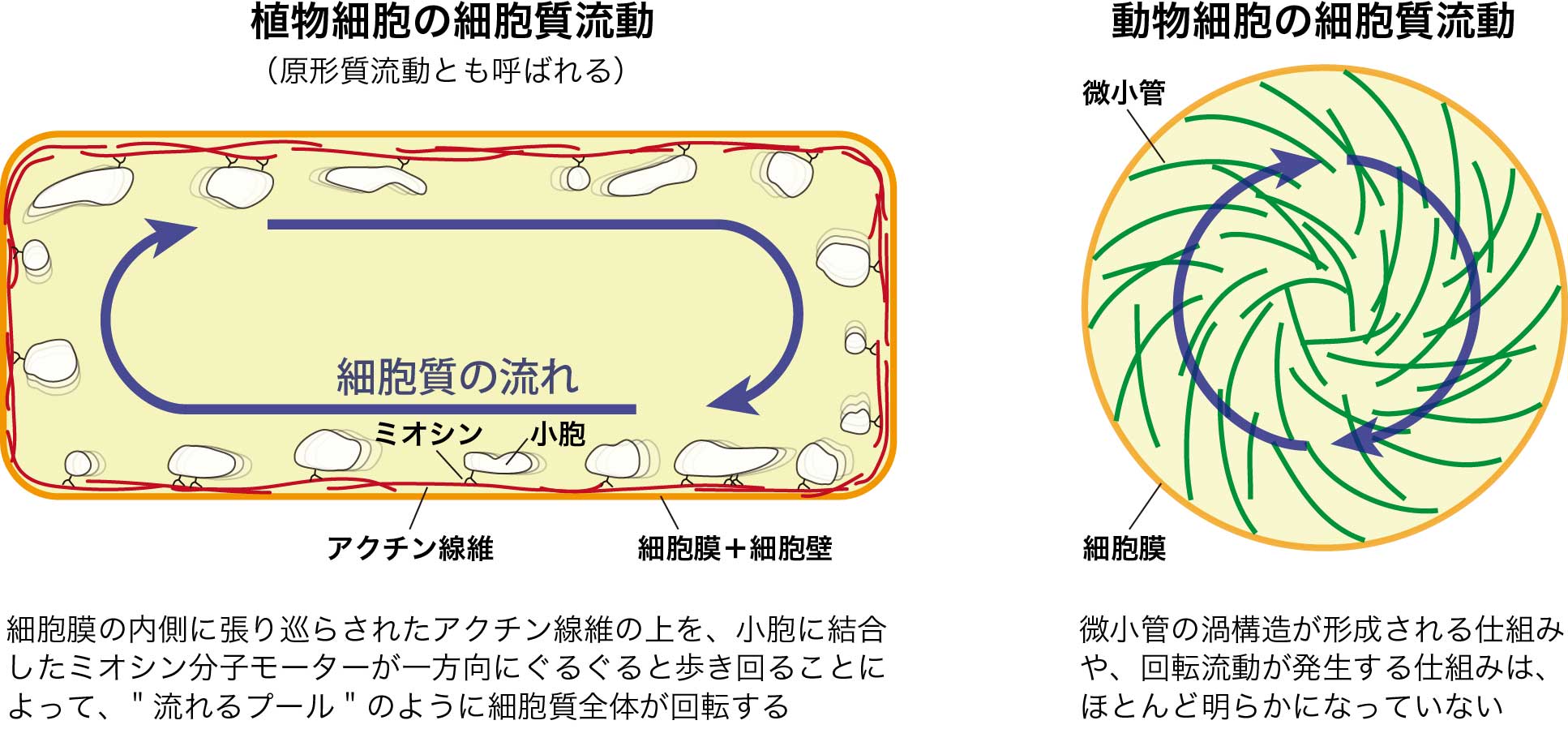
細胞質流動とは?
細胞質流動(cytoplasmic streaming)とは「細胞の内部を占めている液体や細胞小器官(これらを総称して細胞質(cytoplasm)と呼びます)が、細胞内で流れる現象」のことを言います。細胞質流動の研究の歴史は古く、200年以上も前に植物細胞で初めて発見されました。その後、動物細胞でも発見が相次ぎましたがその役割は長らく不明でした。しかし近年の研究によって、細胞質流動は生物の発生過程(受精卵が分裂を繰り返し、成体になるまでの過程)や細胞の成長に重要であることが明らかになりつつあり、現在では「細胞全体に栄養素を行き渡らせるための物質輸送システム」と考えられています。
細胞質流動はどのような仕組みで生じているのでしょうか? これまでの研究によって、細胞質流動には細胞骨格(cytoskeleton)と呼ばれる、主に極性線維と分子モーターから構成されるネットワーク構造が関与していることが明らかにされてきました。極性線維にはアクチン線維と微小管の2種類があります。主に植物細胞で観察されるアクチン線維が引き起こす細胞質流動の仕組みは徐々に明らかになってきましたが、その一方で動物細胞に特徴的な微小管駆動の細胞質流動は未解明な部分が多く残されています。
動物細胞の場合、たとえばウニの受精卵やショウジョウバエの卵母細胞では微小管が細胞の中央を中心として渦状に配列したネットワーク構造が形成され、細胞内のほぼ全域にわたって回転流動が生じること知られています。しかし、どのようにして微小管の渦構造が形成され、細胞質流動が駆動されるのか、その仕組みは明らかになっていませんでした。
新しい方法論の提案:人工細胞をつくって細胞の仕組みを解明する
私たちの研究チームは、細胞骨格が細胞機能を制御している仕組みを解明するために、細胞の中身を一旦取り出し、さらに必要に応じてパーツごとに分離した後、それらをもう一度混ぜ合わせて、細胞を模したカプセルに封入する技術を構築してきました。今回の研究も、この技術で作製した人工細胞を用いて細胞質流動が発生する仕組みの解明に挑みました。
なぜ実際の細胞ではなく、わざわざ人工細胞を用いることにしたのでしょうか? 実際の細胞では細胞の性質を変えずに、大きさのみを変化させることは不可能です。一方で、細胞の中身を一旦取り出して、もう一度カプセルに封入して人工細胞をつくるという方法では、カプセル、つまり“細胞”の大きさを自在に変えることが可能です。また、細胞の中身を一旦取り出しているので、細胞質にいろいろな薬剤を簡単に、しかも精確な濃度で加えることができます。つまり細胞の大きさとは独立に、細胞内の生化学的環境を制御することが可能となります。これらの2つの利点を最大限活用することで、微小管の渦構造形成における細胞膜の壁としての役割と、細胞質流動の駆動力を定量的に調べることが初めて可能になりました。
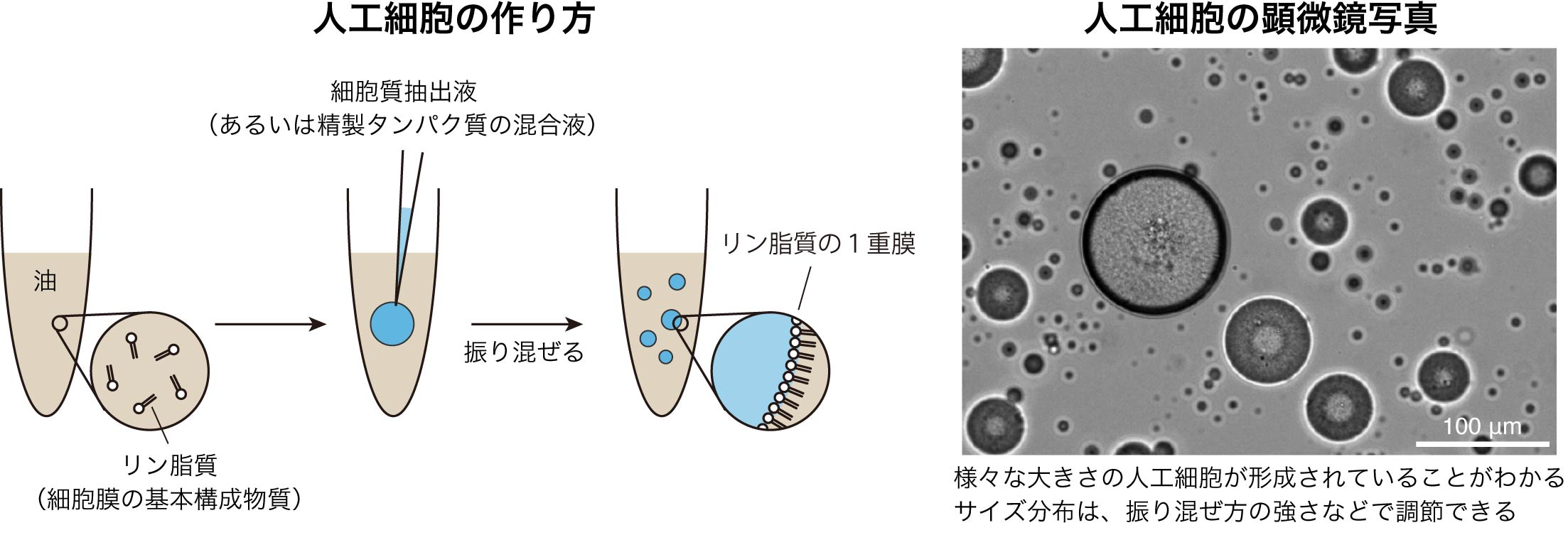
人工細胞のつくり方
私たちは細胞質のモデル系としてカエルの卵を選びました。なぜならカエルの卵は細胞サイズが大きくて扱いやすい、細胞膜を取り除いた状態でも染色体分配など多くの細胞機能が再現されるなどの点で優れているからです。まずアフリカツメガエル(Xenopus laevis)のメスにホルモンを注射して産卵させ、卵を遠心分離機にかけることによって細胞質と、卵の殻などのほかの部分を分離し、細胞質だけを取り出しました。この細胞質抽出液を、細胞膜の基本構成要素であるリン脂質で包まれた油中水滴に封入することで人工細胞を構築しました。油中水滴は、リン脂質を溶かした油の中へ少量の細胞質抽出液を滴らし、ドレッシングをつくるように軽く振り混ぜることで簡単に作製できます。なお、ダイニン分子モーターの機能抑制が細胞質流動の発生に関与していることが細胞を用いた研究で明らかにされていたため、ダイニンの阻害剤を細胞質抽出液に添加することで細胞と同様の条件をつくりました。
細胞質流動の再現に成功!
今回の研究で特に着目したのが、細胞膜の物理的な“壁”としての役割です。棒の片端を持って、もう一方の端を壁に押し当てれば、棒は曲がったり、傾いたりします。私たちはこのようなことが微小管と細胞膜との間でも起こることで微小管の渦構造形成を促進しているのではと予想しました。壁の影響を調べるには、微小管にとって狭い空間と、壁がないとみなせるほど広い空間で形成されるネットワーク構造や流動の様子を観察し、それらを比較すれば良いと考えました。
まず細胞質抽出液を人工細胞に封入しないで観察した場合、微小管どうしが束になり、さらにその束どうしがランダムに架橋された無秩序な網目構造が形成され、細胞質全域で乱流のような不規則で不安定な流れが生じました。続いて、細胞質抽出液を細胞質流動が観察されている細胞と同程度の人工細胞(直径100〜700μm)に封入したところ、微小管束が自発的に渦状に配列し、人工細胞内全域の細胞質が右方向あるいは左方向に回転する大域的な流れが発生しました。この流れは数十分から数時間にわたって持続する安定的な流動でした。
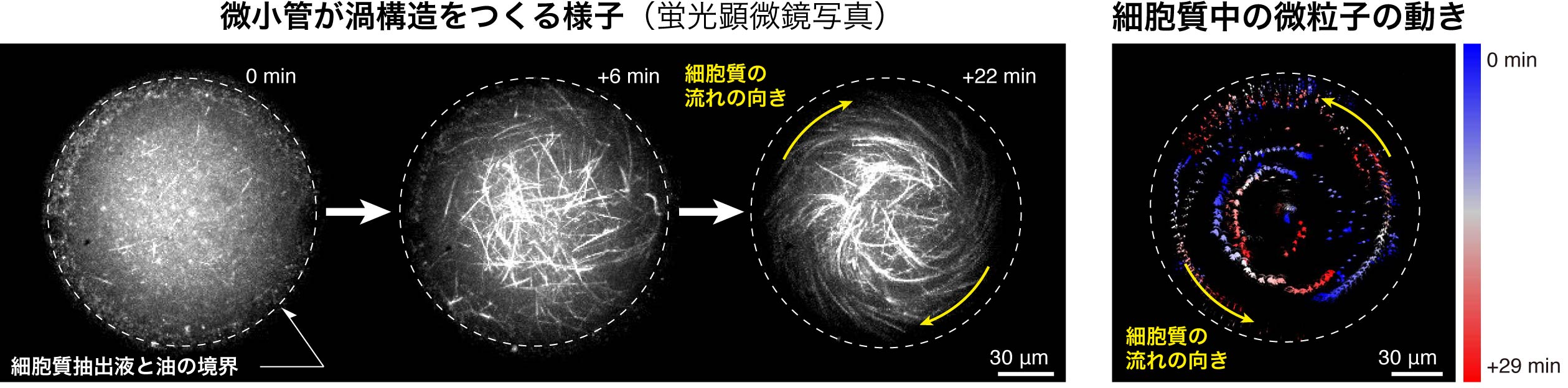
細胞膜を”壁”として利用することで細胞質流動が生じていた!
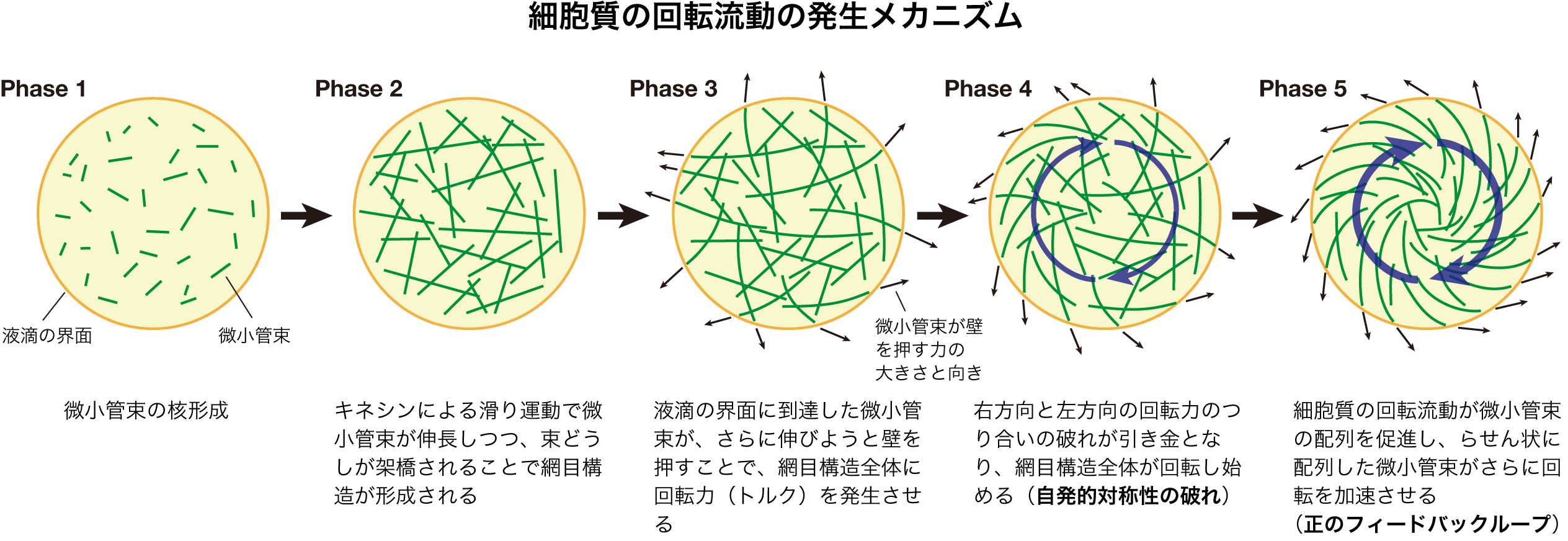
私たちは細胞質流動の再現に成功した人工細胞系を用いて、個々の微小管束の動態、人工細胞の大きさと流速の関係、キネシン分子モーターの阻害効果などを定量的に調べ、渦構造の形成と回転流動のメカニズムを明らかにしました。そのメカニズムは以下のとおりです。
Phase 1:まず、キネシンによって微小管どうしが架橋された微小管束がさまざまな箇所で形成されます。
Phase 2:キネシンは微小管の滑り運動を駆動する分子モーターで、南京玉すだれのように微小管どうしを滑らせることで微小管束が伸びていきつつ、束どうしがさらにキネシンなどで架橋され、微小管束の網目構造が形成されます。
Phase 3:微小管束がさらに伸びて片端が液滴界面にぶつかると、“壁”を押す力を出すようになります。
Phase 4:微小管束は、初めはさまざまな方向を向いているため、境界で発生する力の方向もさまざまであり、それらの間で力のつり合いが保たれますが、微小管束の伸長とともに歪みが溜まっていき、右回転と左回転の力のつり合いがひとたび崩れると、微小管束が壁を押す力の反作用で、網目構造全体が右、あるいは左にゆっくりと回転し始めます。
Phase 5:構造の回転によって生じた流れにより、回転方向に傾く微小管束が増加し、らせん状に配列します。らせん状に配列した微小管束が“壁”を押す力が、さらに構造全体の回転を促進し、回転流動が加速されます。
つまり微小管細胞骨格の自発的対称性の破れと、細胞質の流れと微小管配向の間の正のフィードバックループによって、長時間持続する大域的な回転流動が発生したと考えられます。
棒で壁を押すには、棒そのものがある程度硬くなければなりません。このような物理学的事実から、渦構造の回転には微小管そのものの剛性が重要であると考えられます。私たちの結果は、実際の細胞が細胞膜の物理的な壁としての機能と微小管の剛性を利用することで、長時間持続する大規模な流動を引き起こしていることを示唆しています。
展望:細胞骨格が細胞機能を制御する仕組みの包括的理解
私たちは人工細胞で細胞質流動が再現される物理的および生化学的条件を探ることで、微小管細胞骨格が細胞質流動を引き起こす仕組みを明らかにしました。実は細胞骨格は細胞質流動を駆動するだけでなく、細胞の形態維持から運動・分裂など、生命活動に必須であるさまざまな細胞機能を制御していることが明らかになっています。しかし、細胞骨格がどのようにして多様な細胞機能を制御しているのか、その仕組みは未だにほとんど明らかになっていません。私たちは「細胞を一旦ばらばらに分解してからパーツをもう一度組み合わせ、細胞機能が再構築される条件を探る」という構成的手法を用いることで、細胞骨格が司る多種多様な細胞機能が発現する仕組みの解明に挑戦していきたいと思っています。
参考文献
Kazuya Suzuki, Makito Miyazaki, Jun Takagi, Takeshi Itabashi, and Shin’ichi Ishiwata, “Spatial confinement of active microtubule networks induces large-scale rotational cytoplasmic flow”, Proc. Natl Acad. Sci. USA 114, 2922–2927 (2017).
Makito Miyazaki, Masataka Chiba, Hiroki Eguchi, Takashi Ohki, and Shin’ichi Ishiwata, “Cell-sized spherical confinement induces the spontaneous formation of contractile actomyosin rings in vitro”, Nat. Cell Biol. 17, 480–489 (2015).
Masataka Chiba, Makito Miyazaki, and Shin’ichi Ishiwata
“Quantitative analysis of the lamellarity of giant liposomes prepared by the inverted emulsion method”, Biophys. J. 107, 346–354 (2014).
この記事を書いた人

- 早稲田大学先進理工学部物理学科、助教。2011年、京都大学大学院理学研究科物理学・宇宙物理学専攻で博士課程(日本学術振興会特別研究員DC1)修了後、早稲田大学理工学術院次席研究員を経て、2015年より現職。2016年より早稲田バイオサイエンスシンガポール研究所(WABIOS)研究所員兼任。博士課程までは分子モーターの歩行メカニズムに関する研究をしていました。博士号取得後は、細胞質流動をはじめ、細胞分裂や細胞運動など、細胞骨格が多種多様な細胞機能を制御する仕組みの包括的理解を目指して、人工細胞を用いた研究を進めています。




