タンパク質結晶を細胞内で操る! – カイコがウイルスに感染したときにできる「多角体」を利用
細胞の中でタンパク質の結晶!?
タンパク質は生体内でケージ状や繊維状、2次元シートなどさまざまな集合構造を形成することにより、生命活動に必要な機能を果たしています。これらのタンパク質集合体は、幅広いサイズや形状の単一空間を与えるため、合成分子では構築することができない空間構造が形成されます。したがって、これまでタンパク質集合体を利用した機能性材料の構築が行われてきました。
また、固体のタンパク質集合体であるタンパク質結晶は、タンパク質の構造を決定するために用いられてきました。タンパク質結晶は、タンパク質分子が規則正しく並んでおり、1次元チャネルを形成するタンパク質があります。そのため、これらのタンパク質結晶は、タンパク質の構造を決定するだけでなく、金属錯体や機能性分子を固定化する固体材料としても魅力的なタンパク質集合体です。
しかしながら、タンパク質結晶を作成するには、タンパク質を高度に精製する必要があり、その結晶化は困難なものとなります。また、タンパク質の結晶は一般的に脆く、結晶を作成する条件以外では、溶解してしまいます。したがって、タンパク質結晶を固体材料として利用するには、まだまだ課題が残されています。
そこで、私たちは細胞内で結晶化するタンパク質に着目しました。その特徴はなんといっても結晶化が不要なことです。一般的なタンパク質は、きれいに精製したタンパク質を用いて結晶化を行いますが、一度にたくさんの結晶を得られるわけではなく、しかもタンパク質によっては、結晶ができるまで長い時間を要します。「細胞内タンパク質結晶化」を利用することにより、細胞内で自発的に短期間にタンパク質結晶が作成されます。また、細胞内でタンパク質の結晶が形成されるので、タンパク質結晶の機能化を細胞内で行うことが可能になります。
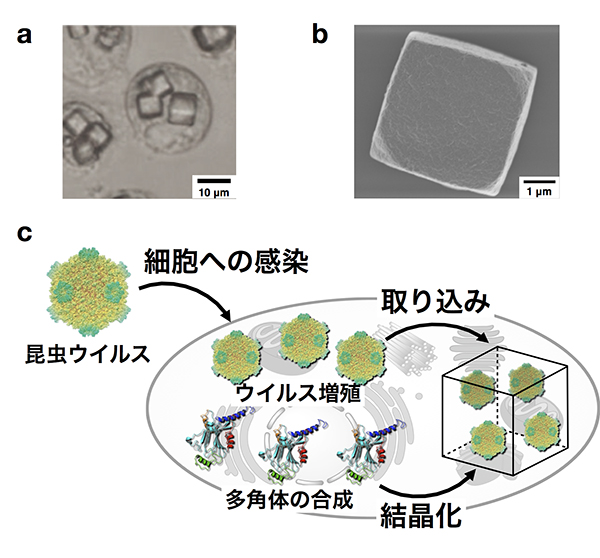
細胞内タンパク質結晶「多角体」
私たちは、細胞内で結晶化するタンパク質として「多角体」と呼ばれるタンパク質結晶に着目しました。「多角体」は、細胞質多角体病ウイルスが昆虫(カイコ)に感染したときに細胞内でできるタンパク質の結晶です。ウイルスに感染するとカイコの細胞内では、ウイルスが複製されると同時に多角体タンパク質が発現されます。興味深いことにその多角体タンパク質が細胞内で結晶化されるときに、ウイルス粒子を閉じ込めながら結晶化します。多角体結晶は、非常に高い安定性を持っているため、内包されたウイルス粒子はその感染力を維持したまま長期にわたって保存されます。ここでは、私たちが開発してきた結晶エンジニアリングによる多角体結晶の機能化について紹介します。
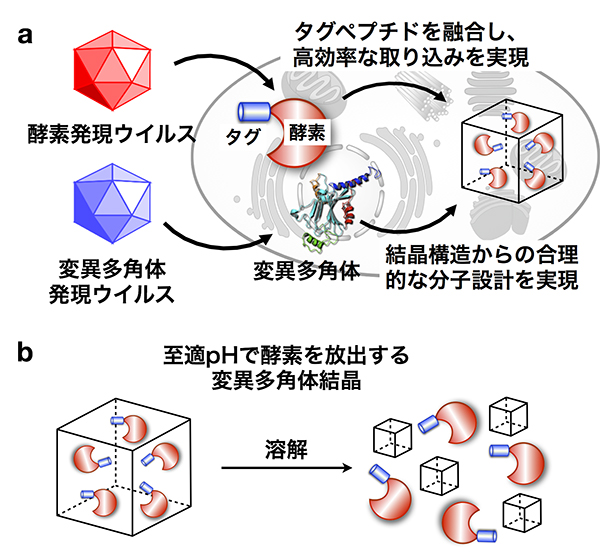
タンパク質結晶の鎧をまとう酵素
酵素は、生体内でさまざまな化学反応を温和な条件で高選択、高効率で行うタンパク質であり、工業的にも注目を集めています。しかしながら、多くの酵素はpH変化や環境に活性が大きく影響され、活性を維持したまま長期保存することは困難です。私たちは、細胞の中で目的とする酵素を合成すると同時に、多角体の内部に包み込むことにより、これまでの酵素の産業利用における課題の解決をめざしました。
多角体結晶への内包を促進するためにタグペプチドを融合した目的酵素を多角体と同時に産生する細胞では、目的酵素を内包した酵素が多数合成されます。さらに多角体のアミノ酸置換によって、酵素の活性を保持したまま、結晶から放出することに成功しました。一連の反応は、ひとつの細胞内で完結されるため、タンパク質精製など煩雑な操作は完全に不要となり、熱やpH変化に弱い酵素や低収量の酵素合成に利用できるだけでなく、結晶からの放出制御を利用した経口薬やワクチンへの応用が期待されます。
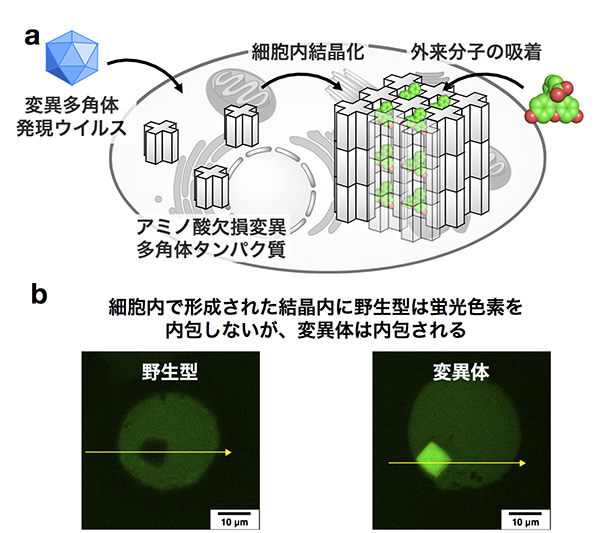
細胞内で機能する分子フィルター
次に、私たちは多角体結晶のエンジニアリングにより細胞内で分子フィルターの役目をする結晶性材料を開発しました。多孔性の結晶材料は、ゲスト分子の貯蔵や分離などさまざまな応用が可能な固体材料として利用が注目されています。しかしながら、細胞内などの生体環境下で利用可能な多孔性材料の開発は、安定性や設計性の問題から未だに困難です。そこで、多角体の利用を考えました。
まず、分子を吸着させるために多角体の変異体設計を行いました。多角体タンパク質のアミノ酸側鎖を欠損した結晶を作成することにより、細胞内で選択的に分子を吸着するフィルターのような結晶材料が構築できると考えました。そこで、多角体タンパク質の分子界面に位置するアミノ酸側鎖を3つ欠損させることにより、本来の結晶パッキングを維持したまま結晶内部の細孔を拡大した多角体を作成しました。設計した変異体は、野生型と同様に昆虫細胞内で結晶化し、その結晶構造から、欠損させた領域以外は、野生型と比べ構造が変化していないことがわかりました。詳細に構造解析を行った結果、変異をかけた分子界面の分子間、分子内の相互作用が弱くなっていることがわかりました。作成した変異体結晶は、細胞内において野生型ではみられない蛍光色素の吸着が変異体結晶において観察され、細胞内で分子吸着するフィルターの作成に成功しました。
さいごに
以上のような技術により、細胞内での選択的な分子認識や吸着、貯蔵が可能となるため、細胞内解毒などに威力を発揮すると考えています。また、タンパク質結晶は、分子の構造解析に用いられることから、細胞内で特定の分子を集積させることにより、これまで困難とされてきた細胞内分子の構造解析や細胞内反応による構造変化を追跡する分子のカゴとしての利用につながると期待されます。
参考文献
1. S. Abe, B. Maity, T. Ueno, “Design of a Confined Environment using a Protein Cage and Crystals in Development of Biohybrid Materials”, Chem. Commun. 2016, 52, 6496-6512.
2. S. Abe, H. Ijiri, H. Negishi, H. Yamanaka, K. Sasaki, K. Hirata, H. Mori, and T. Ueno, “Design of Enzyme-Encapsulated Protein Containers by in Vivo Crystal Engineering”, Adv. Mater. 2015, 27, 7951-7956.
3. S. Abe, H. Tabe, H. Ijiri, K. Yamashita, K. Hirata, K. Atsumi, T. Shimoi, M. Akai, H. Mori, S. Kitagawa and T. Ueno, ”Crystal Engineering of Self-Assembled Porous Protein Materials in Living Cells”, ACS Nano 2017, 11, 2410-2419.
この記事を書いた人

-
東京工業大学生命理工学院 上野研究室 助教。専門は生体関連化学、生物無機化学、タンパク質工学、タンパク質結晶工学。2008年名古屋大学大学院理学研究科博士後期課程修了。博士(理学)。名古屋大学、京都大学を経て2012年より現職。タンパク質、特に現在は細胞内で結晶を形成するタンパク質を利用した機能性分子を創成する研究を進めています。
研究室ホームページ http://www.ueno.bio.titech.ac.jp




