細胞の運命を巻き戻す遺伝子を発見! – 生命と生命をつなぐ仕組みの一端が明らかに
生命の連続性を担う唯一の細胞、生殖細胞
私たちの生はたったひとつの卵にひとつの精子が受精した瞬間に始まりますが、不可逆的な時間経過により恒常性を保つことが困難となった個体は最終的には必ず死へと向かいます。受精卵から生み出される約37兆個、200種類以上の細胞のほとんどは死へ向かう運命にあり、そのなかで唯一、卵・精子の元となる始原生殖細胞へ変化した細胞のみが次世代を再生産することができます。一世代限りの儚い運命の「体細胞」、そして世代を超えて永続的に存在し、種の連続性を維持する「生殖細胞」。なぜ生殖細胞だけにこのような特殊な能力が備わっているのでしょうか? 生殖細胞は、「すべての細胞へ変化できる能力」、「遺伝情報の多様化」、「ゲノム情報の安定性」など体細胞にはない特殊な能力を持っていますが、私たちはそのなかでも「すべての細胞へ変化できる能力」、専門用語で多能性と呼ばれる能力に着目して研究を行っています。
始原生殖細胞によるエピゲノム情報の初期化と全能性
ヒトを含む哺乳動物において、受精卵は生殖細胞を含む体を構成するすべての細胞の供給源である内部細胞塊と胎盤の起源である栄養外胚葉へと分化します。その後マウスの場合、内部細胞塊はエピブラストと呼ばれる細胞へと分化しますが、体軸に沿って前方に存在するエピブラストと後方へ存在するエピブラストでは、分化できる細胞系譜が異なっているため、この時点でエピブラストはすでにすべての細胞へ変化できる能力、いわゆる多能性は消失しているといえます。始原生殖細胞は、後方のエピブラストのなかでも栄養外胚葉から分化して生じた胚体外外胚葉と接する特殊な環境で作られ始め、その後原腸陥入に伴った細胞移動により形成の場を胚体外中胚葉と呼ばれる胚体外領域へ移します。このように特殊な環境に”偶然”位置した数個から数十個のエピブラストのみが次世代を再生産する権利を獲得し、残りのエピブラストは最終的には死んでいく体細胞へと分化するわけです。
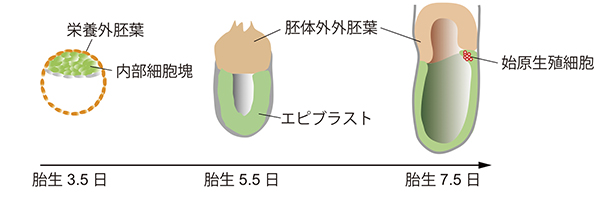
この運命の分かれ道の瞬間から、始原生殖細胞では次世代を再生するために必要な「初期化」と呼ばれる現象が始まることを博士課程の頃に見つけました。生殖細胞研究を始めた当時、遺伝子の付箋紙のような役割を担う、DNAのメチル化やヒストン修飾に関する研究が爆発的に進みつつありました。次世代においてすべての細胞へ分化するためには、少なくともすべての遺伝子を活用できる仕組みが必要です。そこで、始原生殖細胞では遺伝子発現を封じこめる安定的なゲノム修飾が体細胞とは決定的に異なる挙動を示すのではないかと考え、始原生殖細胞のエピゲノム状態やエピゲノム制御因子の発現を調べ続けました。その過程で、安定的な遺伝子発現の抑制に関わるDNAのメチル化とヒストンH3K9(N末端から数えて9番目のリシン残基)のジメチル化が始原生殖細胞だけで消失していき、その直後により柔軟で可塑的な抑制修飾であるH3K27のトリメチル化が上昇することを発見しました。このような現象に基づいて始原生殖細胞による初期化の正体は「遺伝子発現の安定的な抑制修飾から可塑的な抑制修飾への変換(エピゲノムリプログラミング)」であると提唱し、近年次世代シーケンサーを用いた全エピゲノム解析によって、その正しさが裏付けられつつあります。
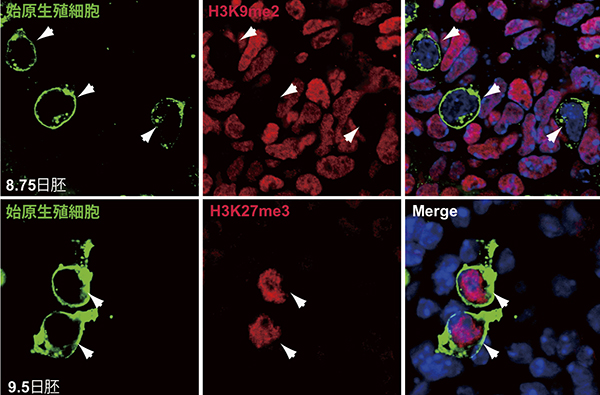
始原生殖細胞の形成に重要な因子、PRDM14
では、なぜ始原生殖細胞のみでこのような大規模なエピゲノム情報の再編集が起こるのでしょうか? 私は、始原生殖細胞のみで発現するエピゲノム制御因子のスクリーニングを行い、PRDM14と呼ばれる分子がES細胞の起源である内部細胞塊と始原生殖細胞のみに発現することを発見しました。当初この分子は始原生殖細胞で起こるH3K27のトリメチル化の促進に関与していると考えており、遺伝子欠損マウスでは始原生殖細胞は形成されるが、エピゲノムリプログラミングが破綻し、減数分裂の開始や次世代で異常が起きると想定していました。ところが、蓋を開けてみると始原生殖細胞の初期分化の異常により、雌雄ともに不妊になることがわかりました。始原生殖細胞は体のなかでは卵と精子のみに分化できますが、体外に取り出し3種類のサイトカイン(bFGF, LIF, SCF)の存在下で培養するとES細胞とほぼ同じ性質を持つ胚性生殖細胞(EG細胞)へ脱分化することが知られています。Prdm14を欠損した始原生殖細胞ではiPS細胞の作製にも用いられるSox2及びKlf2の発現が低いことを突き止めていたので、EG細胞への脱分化能を検証しました。その結果、野生型始原生殖細胞はEG細胞へと脱分化しましたが、Prdm14を欠損した始原生殖細胞はEG細胞への脱分化能を消失していました。予想外なことにPRDM14はエピゲノムの初期化の直前に起こる潜在的多能性の獲得に極めて重要な因子ということが明らかになったわけです。
PRDM14による細胞運命の巻き戻し
遺伝子欠損マウスの解析は、どのような現象にどのような分子が関与しているのか? その問いに対しては明確な答えを出すことができますが、直接的な関与なのか、それとも間接的な関与なのか、またどのような動作原理で制御しているのか、その問いに対しては答えることができません。そこで、ES細胞から分化誘導して作製したエピブラスト様細胞(Epilblast-like cell: EpiLC)にPRDM14を誘導的に発現させることでin vivoの状態を再現し、PRDM14が直接制御する生命現象および分子基盤の解明を試みました。この実験では、PRDM14の「直接的」な下流を探索することが目的でしたので、細胞間相互作用による「間接的」な効果を排除するためにEpiLCにPRDM14を誘導的に発現させ、敢えて「接着」培養を行いました。「どんな細胞へ変化するのだろう?」とワクワクしながら顕微鏡を覗いてみると、偏平状のEpiLCがみるみるES細胞のような形態に変化していきました。
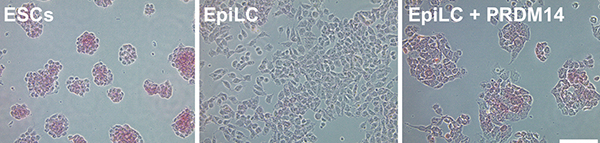
驚くべきことに、ES細胞の未分化性維持に必要なサイトカインであるLIFすらこの培養系には入っていません。ES細胞はin vivoの3.5日胚の内部細胞塊に相当する性質を持ち、一方でEpiLCは5.5日胚のエピブラストに近い性質を持っています。したがって、PRDM14は単独で細胞の運命を約2日間巻き戻す活性を持っているわけです。マウス胚での発現やノックアウトマウスの表現系からPRDM14は始原生殖細胞の分化に必要なマスター遺伝子であると考えてきましたが、この解析結果から始原生殖細胞の分化よりも、むしろ多能性細胞の成立に重要な因子であることがわかりました。
生理的初期化を利用した高品質iPS細胞作製の可能性
今回私たちの研究により、PRDM14が体細胞への分化準備を始めたエピブラストを再び多能性細胞へ巻き戻す働きを持っていることを突き止めました。今回の実験はマウスを用いた解析ですが、同様の現象はヒトでも起きている可能性が高いと考えております。また、ヒトのiPS細胞はドナー細胞のエピゲノム情報を完全に消去できないため、分化しづらかったり、また分化の方向性に偏りがあることが問題となっております。PRDM14にはOCT4、SOX2、KLFにはないDNAの脱メチル化誘導活性というユニークな機能があるため、PRDM14を利用してiPS細胞を作製することで、より品質の高いiPS細胞の樹立につながるのではないかと期待しています。
参考文献
- Seki, Y., Hayashi, K., Itoh, K., Mizugaki, M., Saitou, M., and Matsui, Y. (2005). Extensive and orderly reprogramming of genome-wide chromatin modifications associated with specification and early development of germ cells in mice. Developmental biology 278, 440-458.
- Yamaji, M., Seki, Y., Kurimoto, K., Yabuta, Y., Yuasa, M., Shigeta, M., Yamanaka, K., Ohinata, Y., and Saitou, M. (2008). Critical function of Prdm14 for the establishment of the germ cell lineage in mice. Nature genetics 40, 1016-1022.
- Okashita, N., Suwa Y., Nishimura O., Sakashita N., Kadota M., Nagamatsu G., Kawaguchi M., Kashida H., Nakajima A., Tachibana M., Seki Y. (2016). PRDM14 drives OCT3/4 recruitment via active demethylation in the transition from primed to naïve pluripotency., Stem Cell Reports 7 (6), 1072-1086
この記事を書いた人

-
関西学院大学理工学部生命医化学科准教授
専門は生殖細胞生物学、エピジェネティクス。
1978年生まれ。鹿児島県出身。熊本大学大学院薬学研究科博士課程前期修了後、大阪大学大学院医学系研究科博士課程修了、理化学研究所発生・再生科学総合研究センター基礎科学特別研究員を経て、2009年関西学院大学理工学部専任講師、2014年より現職。




