世界最小の人工バネで、タンパク質の動きを捉える! – 生命科学研究を促進する新しいツールが誕生
ナノの世界の動きを観て操作する
ナノメートル(1ナノメートル=1億分の1メートル)の世界は、私たち人間の世界とどのくらいのサイズの違いがあるか想像できますか? たとえるならば、地球とテニスボールくらいの大きさの違いがあります。ですので、ナノの世界を人間が観たり触ったりすることは、自分が地球の大きさになって、地球上で行われているテニスの試合を観戦し、テニスボールを掴むようなことをしていると言えます。
私たちの体の中のナノの世界は、水中で多種多様なタンパク質がうごめいています。このタンパク質1個1個の動きを観る、もしくは、1個を捕まえて力を加え、その反応を観ることは生命の研究にとても大事なことで、先人たちの努力により、特殊な顕微鏡、レーザー、超高感度カメラや画像解析技術などを用いて実現されています。しかしながら、タンパク質の動きを観ながら力を加え(触る)、その応答を観るという一連の操作を同時にこなすことは、現在の最先端技術を用いても難しく、できたとしても、非常に限られた条件、極端に低い実験成功率になってしまい、ナノの世界の理解をおおきく阻んでいます。そこで私たちは、タンパク質に力を加えるためのナノスケールデバイス、「ナノスプリング」を開発し、力が加えられたタンパク質の動きを詳細に観察する技術を生みだしました。
世界最小の人工バネ「ナノスプリング」の開発
タンパク質1個の動きを観ながら力を加えるという実験のこれまでの問題点は、「観るための装置」と「力を加えるための装置」がタンパク質よりも格段に大きく、たとえるならば、地球サイズの「観る装置」と「力を加える装置」を同時に使って、テニスボールの動きを観て操作しようとしているところにあります。すると、装置の物理的干渉や、実験条件の厳しい制約、実験の複雑化などが起こります。そこで私たちは、「力を加えるための装置」をタンパク質サイズにまで微細化したシンプルなツールを作成することにしました。
私たちが開発した装置は、世界最小のコイル状人工バネであり、ナノスプリングと名付けました。生体分子であるデオキシリボ核酸(DNA)を材料としています。DNAは4種類の塩基からなるポリマーであり、二重らせんの丈夫な構造をとることができます。この二重らせん構造を1本の紐に見立て、編み物を織るように二重らせんを束ねてさまざまな形状のナノ構造物を作成する技術「DNAオリガミ」が、2006年にRothemundによって開発されました。私たちはこの技術を応用して、図1(a)に示したような、3次元的なコイル形状を持つナノ構造物の作成に成功しました。ポイントのひとつは、DNAの二重らせんを束ねるときに、複数か所に微小な構造歪みを持たせて空間的に均一に曲げる設計をすることであり、DNAオリガミ技術を用いてこれまでに作成されたナノ構造物にはなかったコイル形状を生みだすことができました。基本的なサイズとしては、コイル直径が30ナノメートル、長さが100~1000ナノメートルですが、コイル直径、長さや巻き数は設計次第で、ある程度変更することができます。
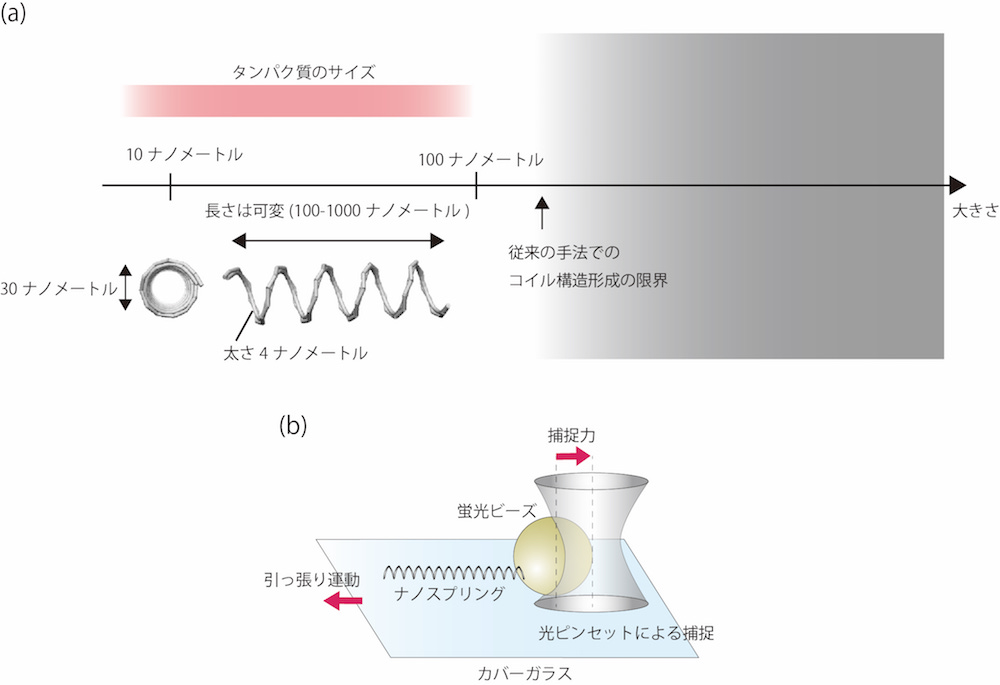
ナノスプリングはバネとして機能するのか?
実際にバネとして機能するかどうかを、図1(b)のように、高出力レーザーで微粒子を捕捉・操作する技術「光ピンセット法」を用いて物性評価を行いました。自然長が300ナノメートルのバネを1000ナノメートルまで伸び縮みさせて力を計測すると、数ピコニュートン(1ピコニュートン=1兆分の1ニュートン)の範囲で、伸びと力が比例関係をもつ線形バネに近い性質を示しました。私たちの最初の目的は、細胞内のタンパク質が生理的に感知する力である数ピコニュートンの力に対する分子応答を観察することでしたので、設計どおりの物性を持たせることができたと言えます。
ナノスプリングの最大の利点は、バネ定数を自在に変更できるプログラム能力です。バネとして機能し得る弾性体分子は多く存在しますが、対象に合わせて形状やバネ定数をチューニングするのは困難でした。また、コイル形状を持たせることで、線形バネに近い物性を持たせることできました。加えて、ナノスプリングの材料となるDNAは化学修飾が容易ですので、さまざまな生体分子や無機分子と連結が可能であり、広い応用範囲を持つと考えられます。
モーター分子にナノスプリングを引っ張らせる
生体における“機械的な力”の役割と仕組みを解明して、発生やがん、再生医療などの臨床的課題の解決を目指す分野をメカノバイオロジーと呼んでいます。その中心課題のひとつが、メカノセンサータンパク質と呼ばれる、力に応答して機能変調する分子の仕組みを調べることです。私たちは、メカノセンサータンパク質の一種であるミオシンVIという分子とナノスプリングを連結して、ミオシンVIの動きを観察しました。ミオシンVIは、動くタンパク質(モーター分子)として知られており、アクチンフィラメントと呼ばれる数珠上のタンパク質上を一方向に運動します。観察の結果、図2のようにミオシンVIの動きによりナノスプリングが引き伸ばされて、徐々に大きな力がかかるのが蛍光観察できました。
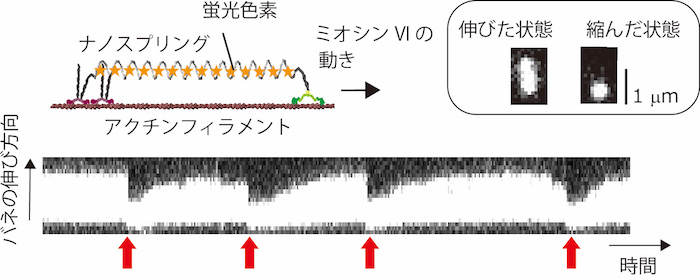
その後、ミオシンVIの生み出す最大力とバネの力が釣り合うと停止し、ミオシンがアクチンから解離することでバネが縮むのも観察できました。観察方法の詳細やミオシンVIの力に対する応答機構および生理的意義は参考文献に譲りますが、ミオシンVIの動きと機能が力に応答して変化していく様子が、図3のように、初めて直接観察されました。
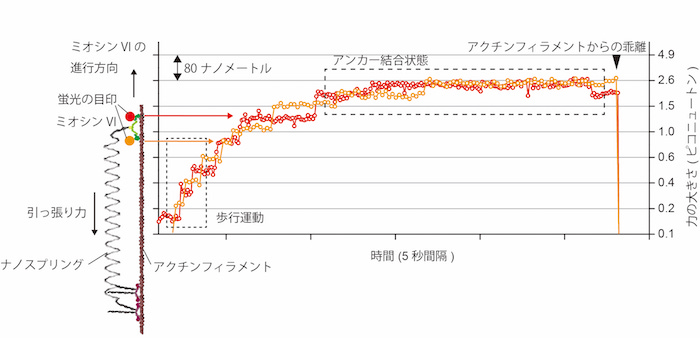
このように、ナノスプリングは単なる極小のおもちゃではなく、生命科学研究において有用なツールとなることが示されました。
おわりに
今回のナノスプリングの応用としての出口は生命科学分野であり、生命科学分野でよく使われる超解像蛍光顕微鏡・電子顕微鏡や原子間力顕微鏡との併用によって、メカノバイオロジーに必須のツールになると期待しています。今後、光などの外部刺激によって、ナノスプリングを伸展させたり短縮させたりできるようになると、能動的に力の調節をすることが可能となります。さらには、細胞内や細胞間にナノスプリングを組み込むことで、生命の発生過程における細胞集団や組織の形態形成の力場イメージングや力学制御が可能となるため、現在研究を進めています。生命科学分野以外でも、DNAにさまざまな化学修飾を施すことで、生体分子以外にも、化学合成された機能性分子(ナノマシンとも呼ばれ、2016年のノーベル化学賞の受賞対象)との連結によって極微細な動力システムへの利用、金ナノ粒子をナノスプリングに沿ってコイル状に配置させることによって、極小のコイル状金属配線などへの応用も考えられます。
参考文献
- P.W. Rothemund: Nature, 440, 297-302 (2006)
- 岩城光宏、ポリヌクレオチドを用いたコイル及びその製造方法(特許第6041306号)
- M. Iwaki, S.F. Wickham, K. Ikezaki, T. Yanagida, W.M. Shih: Nat. Commun., 7, 13715 (2016)
この記事を書いた人
- 理化学研究所・生命システム研究センター・上級研究員/大阪大学大学院・生命機能研究科・招へい准教授。筋肉や心臓などの生命の動きを司る動力システムをデザインして、自作の顕微鏡を用いてシステムの動きをタンパク質1個レベルで観察することを行っています。今回のナノスプリング開発もその一環で、生命の持つ超低消費エネルギーや丈夫で柔軟なシステムの原理を理解して社会応用できればと思っています。個人ページはこちら。




