ヒトは冬眠できるのか? – 冬眠が基礎代謝を下げるメカニズムを解明し、臨床応用を目指す
基礎代謝の維持は生命の土台
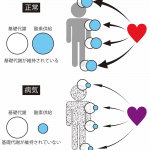
基礎代謝とは、動物が生命維持に必要な最低限のエネルギーのことを指します。動物を構成するすべての細胞に、それぞれの基礎代謝が存在し、それらを維持するために私たちの体は呼吸を行い酸素を取り込み、心臓を用いて酸素を含んだ血液を体中に循環させています。つまり、基礎代謝の維持は生命の土台なのです。このため、致死的な疾患では重要な臓器の基礎代謝が維持できなくなることが多いです。
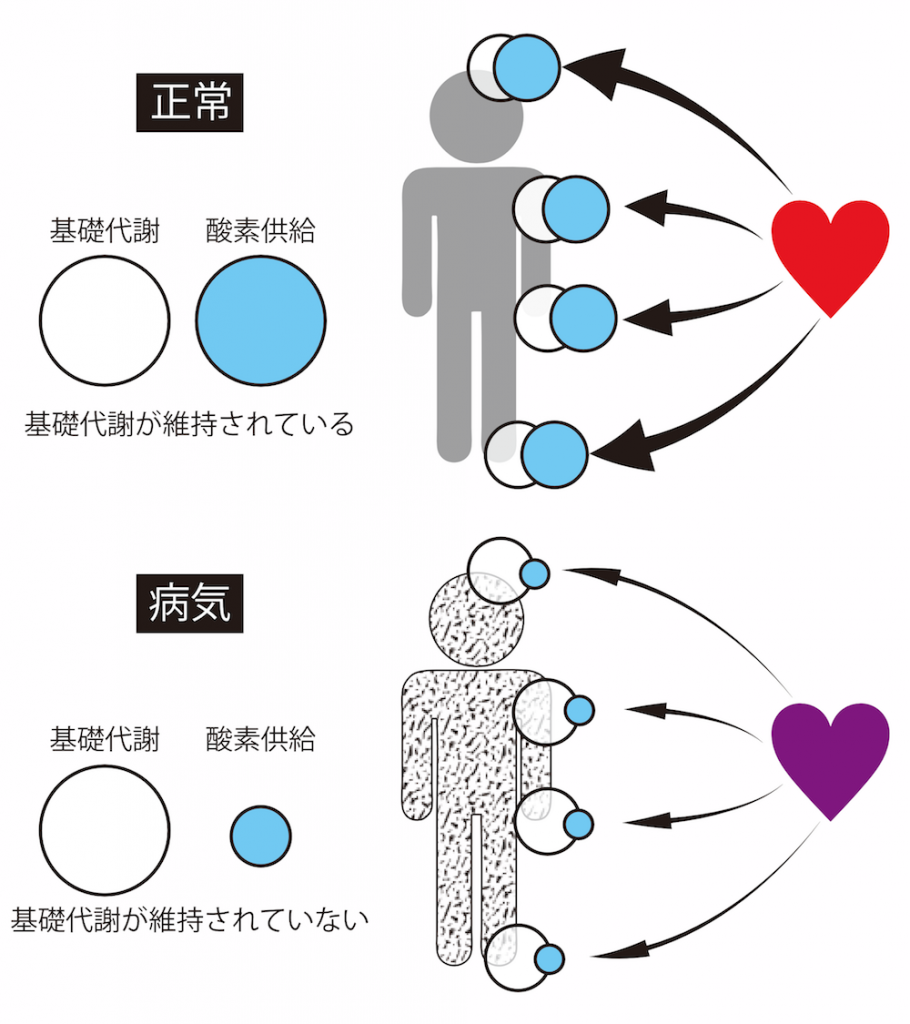
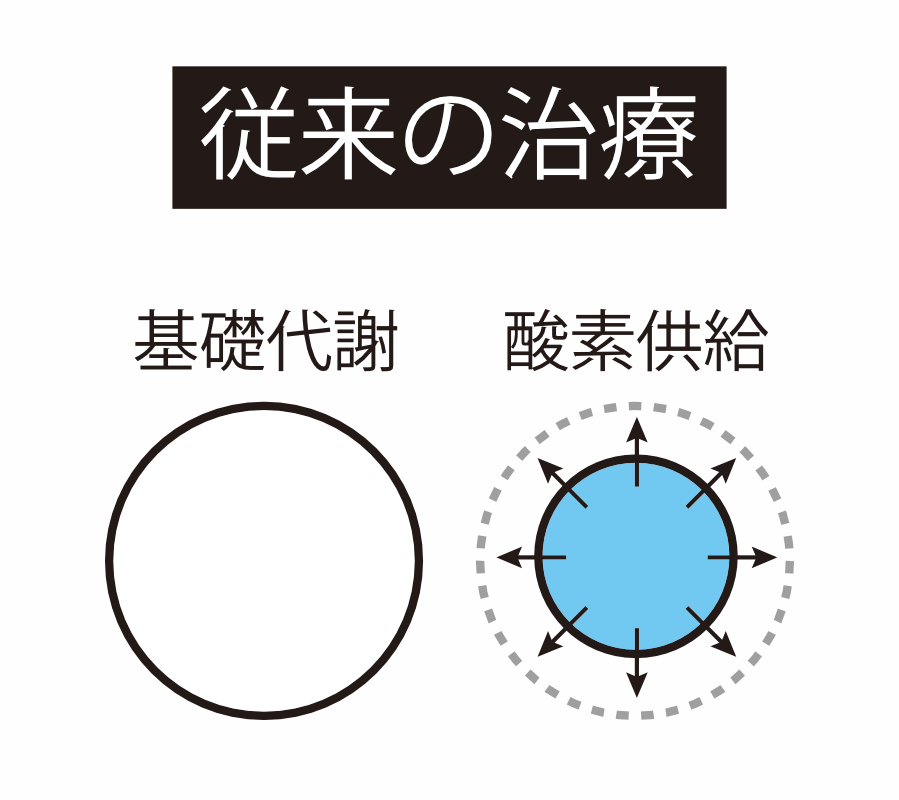
たとえば、心筋梗塞や脳梗塞は特定の臓器に血液が循環しなくなったために酸素不足が生じ、結果的に基礎代謝が保てなくなり臓器が損傷します。あるいは、出血や脱水によって十分な循環血液量が保てなくなると、末梢まで酸素を運搬できなくなり、多くの臓器・組織で基礎代謝を保てなくなり、多臓器不全となります。また、重症な肺炎になると肺で十分な酸素を取り込めなくなるために、体中の組織が酸素不足となり基礎代謝が保てなくなり、多臓器不全に陥ります。このような基礎代謝が保てない状態に対して、今日の医療では通常よりも高濃度の酸素で呼吸を行わせたり、補液によって循環血液量を増やしたり、心臓をより強く働かせたりなど、基礎代謝を維持することを目指して治療を行うことが一般的です。
基礎代謝を自ら下げてしまう現象: 能動的低代謝
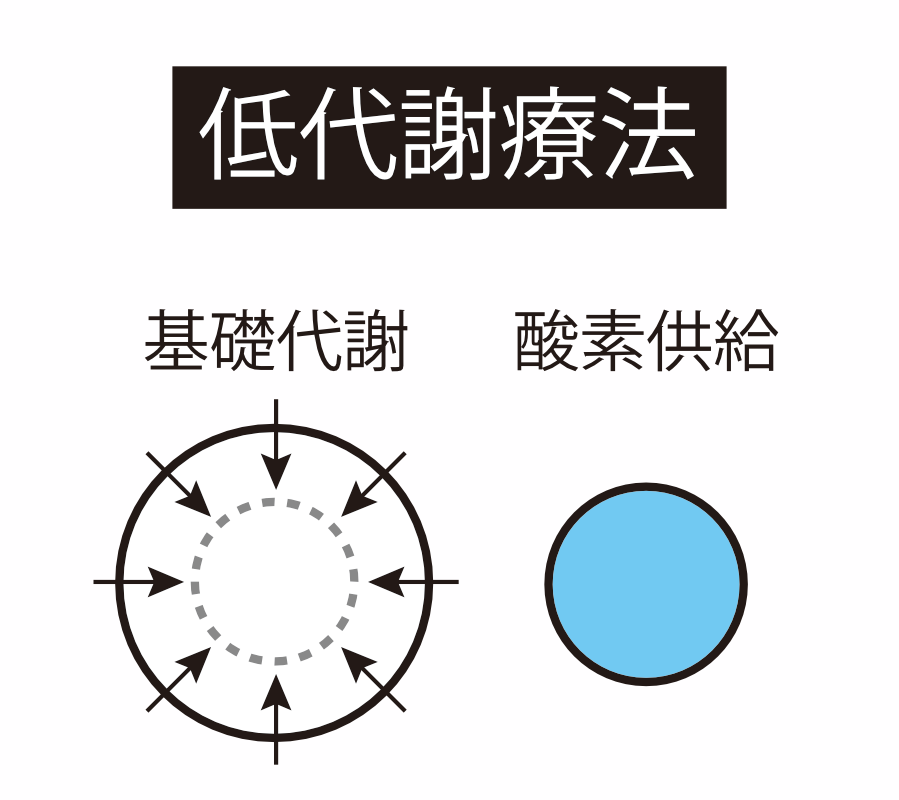
このように、動物にとっては基礎代謝の維持は命綱です。基礎代謝は動物の酸素消費量で測定できますが、驚くべきことに、この酸素消費量を通常の2-3%程度にまで下げても生きている哺乳類が存在します。前述したとおり、酸素消費量が低下すると一般的には全身の基礎代謝が保てなくなり、生命の危機に瀕するわけですが、これらの動物は、酸素消費量だけではなく、基礎代謝そのものを低下させることで、少なくなった酸素消費量でも生き延びてしまいます。
この驚くべき現象は能動的低代謝と呼ばれており、よく知られているのは冬期にみられる冬眠現象です。冬眠といえばリスやクマを想像される方が多いと思いますが、実は哺乳類に広く見られる現象です。2005年に国立成育医療センターの集中治療部でレジデントとして働いていた私は、偶然に冬眠するサルの論文に遭遇しました。そして、人間でも冬眠を誘導できれば、基礎代謝を維持するのではなく基礎代謝を下げることでさまざまな病気を治療あるいは管理できるのではないかと、その瞬間から考えるようになりました。この論文との邂逅で、私は研究者の道を歩み始めました。冬眠の臨床応用による低代謝療法が実現すれば、今では助からない人々が一人でも多く助かるようになるのではないかという思いで、研究の世界に飛び込みました。
人間に冬眠を実現するためには
冬眠が基礎代謝を下げるメカニズムについては、まったくと言ってよいほどわかっていません。冬眠を知るには冬眠動物を用いるのが筋ですが、そもそも動物の入手が困難であったり、冬眠は季節性の現象なので効率よく冬眠実験ができるわけでもなく、研究対象として扱いにくい部類の動物と言わざるを得ません。さらに、冬眠動物のゲノム情報が不足していることもあり、この10年間で大きく進歩した遺伝子工学や分子生物学、ゲノムリソースに基づく解析などの最新の研究ツールを用いることがとても難しいのが現実です。
そこで、そのような最新の科学技術を縦横無尽に駆使できる動物でありながら、能動的低代謝を呈する動物としてマウス(ハツカネズミ)に目をつけました。マウスは冬眠はしませんが、休眠と言われる短い能動的低代謝を行うことが古くから知られていました。マウスの休眠は冬眠と比べると、数十分から数時間と期間が短く、基礎代謝の低下率も正常時の30%程度という軽い特性ではあるものの、実験室で比較的効率的に低代謝を誘導できることや、哺乳類のなかでは飛び抜けて豊富なゲノムリソースが揃っており哺乳類のモデル生物として最も慣れ親しんだ実験動物であることなどに魅力を感じたのです。

休眠と冬眠の共通点
冬眠動物は低代謝に入ると、2週間程度代謝が下がったままになります。このあいだにさまざまな実験を行うことができるため、冬眠動物の体温制御機構は古くから調べられています。一方で、マウスの休眠は低代謝期間が短いことや、対象動物が小さいこと、個体間のバラツキが大きいことから、休眠中の体温制御機構はよくわかっていませんでした。
そこで私たちは、まずマウスの休眠を安定的に評価できる系を整備し、さらにマウスの休眠を効率よく誘導できる条件を探索しました。最終的に、外気温が12〜24度の条件だと、エサを24時間抜くだけで休眠を100%誘導できることがわかりました。さらに、この系を用いて休眠中の温度制御機構を調べたところ、驚くべきことに熱産生の感度(外気温と設定温度の差に対してどれほど積極的に埋めようとするか)は、冬眠動物と遜色ない程度に低下していることがわかりました。

一方で、設定温度は冬眠動物と異なり、ほとんど低下していないこともわかりました。マウスは設定温度を下げるのではなく、主に熱産生の感度を下げることで代謝を低下させていたのです。この冬眠動物との違いはさまざまな理由が考えられますが、ひとつは動物が目標温度を変化させるために一定の時間を要するのではないかという考察ができます。冬眠動物でも目標温度が数日かけて徐々に下がっていくことが報告されており、マウスの休眠くらいの短期間な能動的低代謝であると、目標温度を下げるているあいだに低代謝の期間が終わってしまうという可能性です。この違いは興味深いですが、注目すべきは数分単位で変化しているであろう熱産生感度の低下がマウスでも冬眠動物と同様にみられる点です。今回の研究成果により、冬眠動物を研究対象としなくても、マウスの休眠メカニズムを調べることで、能動的低代謝に重要である「熱産生感度の低下」の原理を明らかにできる可能性が出てきたと言えます。
休眠のメカニズムから臨床応用までの遠い道のり
私は博士課程で哺乳類の睡眠制御機構の研究を行っていました。外面上は睡眠と冬眠は似ていますが、原理から考えると大きく異なる点があります。それは、睡眠は脳という「臓器」が主たる舞台の現象であるのに対して、冬眠は一つ一つの臓器の「細胞」が主たる舞台の現象であることです。今の科学では睡眠は脳がないと再構成(あるいは合成)できませんが、代謝という観点から考えると、冬眠は細胞レベルで再構成できる可能性があると考えています。
私たちはマウスの休眠を自由に誘導できる系を手にしたので、次は試験管の中で細胞レベルの休眠を誘導し、生理学・バイオインフォマティクス・遺伝子工学を総動員して休眠現象のメカニズムに迫る研究をしたいと考えています。ただし、たとえ試験管の中で細胞レベルの休眠メカニズムがわかったとしても、臨床への道のりは遠く険しいと考えています。細胞から個体へのスケールの壁がありますし、マウスから人間への種の壁も存在します。それでも、能動的低代謝というとても不思議な現象の理解ができるのではないかという科学者としての期待感と、人間の安全な低代謝が実現した際にどれほどの人名を救命できるのだろうかという臨床家としての期待感とを胸に、研究を推し進めていきたいと考えています。最後になりましたが、能動的低代謝の臨床応用や原理解明に興味がある方はぜひともお声掛けください。冬眠という自然が作り出した神秘的な現象を解明しながら、人間に能動的低代謝を応用してこれからの社会を変えてみませんか?
この記事を書いた人
- 福岡県生まれ。小児科医&研究者。京都大学医学部を経て大阪赤十字病院、国立成育医療センターで医師として勤務。その後、大学院へ進学し理研CDBシステムバイオロジー研究チームで哺乳類の睡眠制御機構の研究に従事。現在、理研CDB網膜再生医療研究開発プロジェクトにて冬眠の臨床応用を目指して研究中。冬眠で医療を変えたい。