タンパク質の形を迅速に決定する手法で拓く、タンパク質構造ダイナミクス研究の新時代
研究の背景
生物の体の7割は水分ですが、残りの3割はタンパク質などから出来ています。人体には形の異なる2万5000種ものタンパク質があって、それぞれの形に応じて機能を発揮する分子機械として生命活動を支えています。タンパク質のはたらきを理解するには、その形を知ることが必要ですが、形がわかっているタンパク質は今日でもまだ一部に過ぎません。
みなさんは小さいものを見るときに何を使うでしょうか? 虫メガネや顕微鏡を利用すると思います。タンパク質は、100万分の1ミリメートル程度のサイズであまりに小さいため、レンズを使って観察することはできません。分子や原子レベルの極小の世界を分析する特別な技術、X線結晶構造解析が必要になります(図1)。
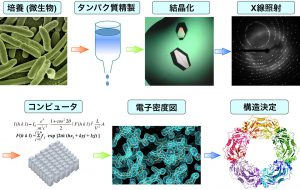
ミラーボールは可視光を反射して室内にカラフルな斑点状の模様を映し出します。同様に、結晶はX線の光を反射して検出器のスクリーンに模様を映し出します。X線結晶学者はその模様の形状をコンピュータにインプットし、レンズの替わりに物理の数式を駆使して、結晶を構成する分子や原子の形を描き出すことが出来ます。つまり、タンパク質の結晶を作ることができれば、タンパク質の形を見ることができるのです。しかし、タンパク質の結晶をつくる作業はとても大変です。たとえば結晶のひとつである宝石も大きい宝石ほど美しく輝き、希少価値がありますが、結晶の成長過程で形が歪んだり不純物が混入して成長が止まってしまうため、大きな結晶はなかなか得られません。タンパク質で大きな結晶をつくることは、宝石を手に入れるよりずっとコストがかかります。そこで小さな結晶でも明瞭な光の反射模様を映し出すために、強力なX線を照射する必要が出てきます。
夢の光、X線自由電子レーザー
わが国では2011年、国家基幹技術として、X線自由電子レーザー(XFEL)を生み出す最先端施設SACLAが兵庫県播磨科学公園都市に建設されました(図2)。SACLAは、加速器の中で電子の集まりを正確な制御の下で一斉に振動させることで、SPring-8などの従来の放射光施設がつくるX線の10億倍もの明るさをもつXFELの光を生み出します。私たちはこの5年間、その強力なXFELを利用して、数十ミクロンもない微結晶からタンパク質の構造を解明する技術を開発する研究に取り組んで来ました(理化学研究所、高輝度光科学研究センター、大阪大学、京都大学、東京大学、高エネルギー加速器研究機構などからの研究者で組織されたチームによる国家プロジェクト)。そして、多数の微結晶をインジェクターから噴出しながら、XFELを連続的に照射して結晶構造を解析する、“連続フェムト秒解析システム”をSACLAで構築しました。これにより、従来の大型結晶を調製する手間を省くことができるとともに、もともと微結晶しか出来ないような難しいタンパク質の形を見ることができるようになりました。

SACLAのXFELは、1秒間に30発発射される光の弾丸として、微結晶の流れに向けて機関銃のように照射されます。XFELの軌道上にタイミングよく入った1つの微結晶にヒットした1発のXFELは、10フェムト秒(100兆分の1秒)かけて結晶を貫通し、その衝撃で結晶は一瞬で崩壊してしまいます。ですが、その崩壊が起こる前に、まさに光の速さで結晶から反射したXFEL光の模様がスクリーンに記録され形を見ることできるため、結晶が損傷しても問題ありません。数万から数十万個の微結晶についてのデータを数時間かけて測定し、常温で放射線損傷のないタンパク質の真の構造を解明できます。XFELの登場により、従来の放射光X線で問題となっていた、測定中の結晶の凍結や放射線損傷がもたらすタンパク質が歪んで見えてしまう現象が克服されました。
タンパク質構造情報の宝庫を開く鍵
XFEL光の反射模様からコンピュータでタンパク質の形を描き出す際には“位相情報”という暗号を必ず解読しなくてはなりません。私たちは、タンパク質の中にある金属原子や硫黄原子にXFELが当たったときに起こる異常散乱を利用して位相情報を解読し、タンパク質の形を解明することに成功しました。特に、異常散乱を起こしやすいヨウ素原子を含む界面活性剤(洗剤の主成分で膜タンパク質にくっつき易い性質をもつ)を新たに合成して、これを微結晶と混ぜるだけで、効率よく膜タンパク質の位相情報を解読して構造決定できるシステムを開発したことは重要です(図3)。
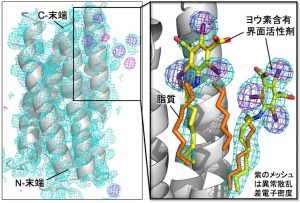
膜タンパク質は、生体膜に組み込まれて存在しており、物質の輸送、情報伝達、エネルギー合成といった重要な機能を担っています。油となじみやすく水に溶けにくいため、生体膜の外に存在する水溶性タンパク質と比べて取扱いが難しく、立体構造の決定に多くの時間・費用・労力がかかるという問題がありました。膜タンパク質は、がん・生活習慣病・神経変性疾患・アレルギー等の多様な疾病に関与するため、創薬ターゲットとして注目されており、その機能を阻害または促進する化合物が薬の候補として盛んに探索されています。私たちの連続フェムト秒解析システムにより、膜タンパク質の構造解明が効率化され、その形を基礎にした新薬の設計・開発が進むことが期待されます。
静止構造から動的構造へ:タンパク質構造ダイナミクス研究の新時代
連続フェムト秒解析を応用すると、タンパク質がはたらく際にその構造が変化し動いてゆく様子をムービーのように見ることが出来ます(時分割解析)。すでに私たちは、バクテリオロドプシンなどの膜タンパク質でもその技術を実証する事に成功しており、理論的には、ピコ秒(1兆分の1秒)の短さで済んでしまうような極めて速い反応も高解像度で捉えることが可能です。将来、数多くのタンパク質の構造と機能を空前の視点で理解できるようになり、その知見が医療分野やデバイス開発への応用へと展開されるようになるでしょう。
参考文献
1.Nakane T et al & Mizohata E (2016). Membrane protein structure determination by SAD, SIR, or SIRAS phasing in serial femtosecond crystallography using an iododetergent. PNAS 113(46), 13039-13044. doi: 10.1073/pnas.1602531113
2.Fukuda Y et al & Mizohata E (2016). Redox-coupled proton transfer mechanism in nitrite reductase revealed by femtosecond crystallography. PNAS 113(11), 2928-2933. doi: 10.1073/pnas.1517770113
3.Nango E et al & Iwata S (2016). A Three Dimensional Movie of Structural Changes in Bacteriorhodopsin. Science 354(6319), 1552-1557. doi: 10.1126/science.aah3497
この記事を書いた人

-
大阪大学大学院工学研究科・講師
タンパク質の形を明らかにして、生命現象の仕組みを分子レベルから理解する研究を進めています。タンパク質構造をもとにした創薬研究にも取り組んでおり、製薬企業と連携しながら、がん等の病気の治療につなげることを目指しています。個人ページURL
この投稿者の最近の記事
 研究成果2016年12月23日タンパク質の形を迅速に決定する手法で拓く、タンパク質構造ダイナミクス研究の新時代
研究成果2016年12月23日タンパク質の形を迅速に決定する手法で拓く、タンパク質構造ダイナミクス研究の新時代



