糖尿病はなぜ発症するのか? – マウスを用いた新たな発症メカニズムの解明
糖尿病とは
糖尿病は主に、1型糖尿病と2型糖尿病に大きく分けられます。1型糖尿病は、インスリンを分泌する膵ランゲルハンス島のb細胞が破壊され、インスリン分泌不足になり、血糖が上昇することにより発症します。一方、2型糖尿病は、肥満をはじめとした生活習慣、加齢、何らかの遺伝的素因により、インスリンの効きが悪くなり、血糖が上昇することにより発症する糖尿病であり、現在の糖尿病患者数の約9割を占めています。
2型糖尿病は、患者数が2000万人にのぼる国民の5人に1人は罹患する成人病で、網膜症や腎症といった合併症を引き起こし失明や透析の原因となるだけでなく、高血圧症、脂質異常症と共に動脈硬化性疾患(心筋梗塞や脳梗塞)を誘発し、健康寿命を短縮させる病気です。さらに、我が国の糖尿病における国民医療費は8兆円になるとも言われています。したがって、2型糖尿病の病態生理を理解することは、国の医療費を削減する上でも重要な課題であるとも言えるのです。
2型糖尿病の原因 – インスリン抵抗性とは
2型糖尿病の主な原因は、インスリンの効きが悪くなる「インスリン抵抗性」です。インスリンが細胞表面のインスリン受容体に結合すると、受容体が活性化し、その後、細胞内のさまざまな蛋白が活性化されます。この一連の流れ(=インスリンシグナル)が遮断されることをインスリン抵抗性と呼んでいます。その主な発生原因は、肥満です。現在、世界の肥満人口は約6億4千万人と言われ、10年後には5人に1人が肥満になると言われています。近年、我が国において食生活の欧米化による肥満に伴い、2型糖尿病患者数およびその予備軍が急増しています。
肥満は、脂肪組織を形成する脂肪細胞自体が大きくなること(肥大化)、または脂肪細胞の大きさには変化ないが、脂肪細胞の数が多くなること(増殖)のいずれかにより起こります。脂肪細胞は、体内の脂肪分を中性脂肪の形で貯蔵するのみではなく、ホルモンを分泌する内分泌臓器であることが知られています。肥満により脂肪細胞が肥大化すると、これらのホルモンの分泌が低下し、インスリン抵抗性の発症に関与します。
近年、肥満によるインスリン抵抗性の発症に、脂肪組織、肝臓、骨格筋などのインスリンが作用する臓器の慢性炎症の関与が重要であることが明らかにされました。これらの慢性炎症には、マクロファージ、樹状細胞、T細胞、B細胞、好酸球、NK細胞、innate lymphoid cellなど、さまざまな免疫細胞が関与しています。これらの慢性炎症では、炎症性サイトカインという液性因子が放出されます。炎症性サイトカインには、先に述べたインスリンシグナルを遮断する作用があり、インスリン抵抗性が発症すると考えられています。しかし、各インスリン感受性臓器をはじめとした標的臓器に、これらの免疫細胞がどのようにリクルートされていくかなどの時系列を追った分子メカニズムに関しては、不明な点が多くありました。
高脂肪食で腸の長さが変わる?
最近、全身の肥満、インスリン感受性に、腸内細菌をはじめとした腸内環境が大きな影響を及ぼすことが報告されています。腸管は、外界の異物と最初に接する臓器であり、免疫機構のみならず、様々な防御機構を有しており、腸管内においては、宿主側と腸内細菌叢がバランスを保ちながら、腸内環境を形成しています。
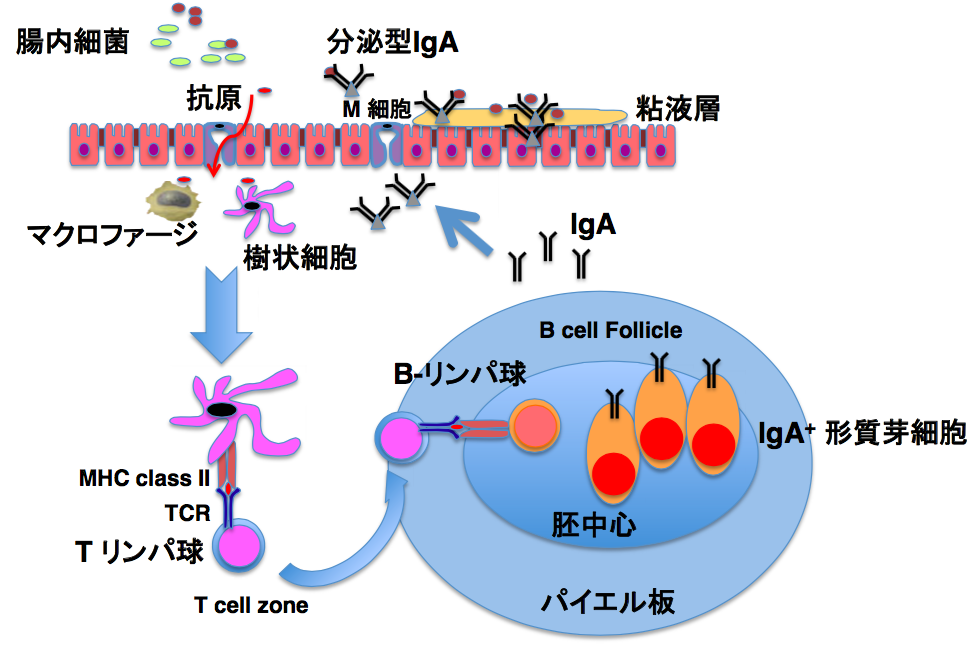
これまで、腸内細菌叢が全身のインスリン感受性に影響を与える報告が多いなか、腸管免疫細胞の糖・エネルギー代謝調節に関しては、あまり知られていませんでした。しかし、その中でマクロファージ・樹状細胞といった単核貪食細胞は、腸管内の抗原を取り込み、T細胞へ提示する役割を有しており、腸管の慢性炎症・全身のインスリン感受性への影響・2型糖尿病の発症といった観点から、なんらかの役割を担っていることが推測されます。実際、腸管マクロファージは、哺乳動物の腸管の中で最も多い白血球の一つであり、体内の中での単核貪食細胞群としては最大です。
マウスに、脂肪分のうち約70%に飽和脂肪酸を含む「高脂肪食」を与えたところ、4週間で大腸の長さが短縮し、マウスの盲腸が小さくなります。

大腸の長さの短縮は、炎症の特徴であり、盲腸の大きさの変化は腸内細菌叢の変化を物語っています。したがって、飽和脂肪酸を多く含む食事により、大腸に炎症が起きることが推測されます。私たちは、同じ食事を与えて、どのくらいの期間で体の各臓器で炎症が起きるかを、大腸、小腸、内臓脂肪組織、肝臓の臓器別に検討しました。すると、これまでインスリン抵抗性の発症に大きく関与していると言われていた脂肪組織、肝臓よりも早く大腸で炎症性のマクロファージに関係している遺伝子の発現の上昇が認められ、実際に炎症性マクロファージの数も増加していることがわかりました。以上のことは、これまで言われていたこととは異なり、高脂肪食負荷では大腸で最も早く慢性炎症が起きることを示唆しています。
炎症性腸管マクロファージの数を減らすとどうなるか?
大腸の炎症性マクロファージの増加がマウスにどのような影響を与えるのか?ということを明らかにするためには、その増加を抑えて影響を見ることが常道です。一般に、炎症性マクロファージの数を制御するのは「ケモカイン」と「ケモカイン受容体」です。
ケモカインとは、炎症性の免疫細胞(マクロファージを含む)を炎症の場に引き寄せる液性因子であり、さまざまな細胞から分泌され、さまざまな種類があります。ケモカイン受容体とは、それらケモカインが結合する受容体で、免疫細胞の膜表面にあり、それぞれのケモカインに呼応する種類の受容体が存在します。マクロファージの場合、局所のケモカイン産生に呼応して、骨髄および末梢血液中にあるそのケモカインが結合するケモカイン受容体を持つ単核球がその局所に移動して、炎症性マクロファージになると考えられています。
私たちの検討によると、マウス大腸では高脂肪食負荷によりCcl2というケモカインが大腸の腸管上皮から分泌され、Ccr2というケモカイン受容体を持つ炎症性マクロファージが集まってくることが明らかになりました。そこで、マクロファージのCcr2を欠損させたマウス(M-Ccr2KO)と腸管上皮でCcl2を欠損させたマウス(Vil-Ccl2KO)を作製し、高脂肪食を食べさせて影響を検討しました。どちらのマウスも予想通り、高脂肪食を食べさせても大腸の炎症性マクロファージは増加せず、目的のマウスを作製できたことを確認しました。両マウスとも対照群のマウスと同様に肥満を呈したにも 関わらず、ブドウ糖負荷による血糖の上昇は抑えられ、インスリンの効きも良くなりました。
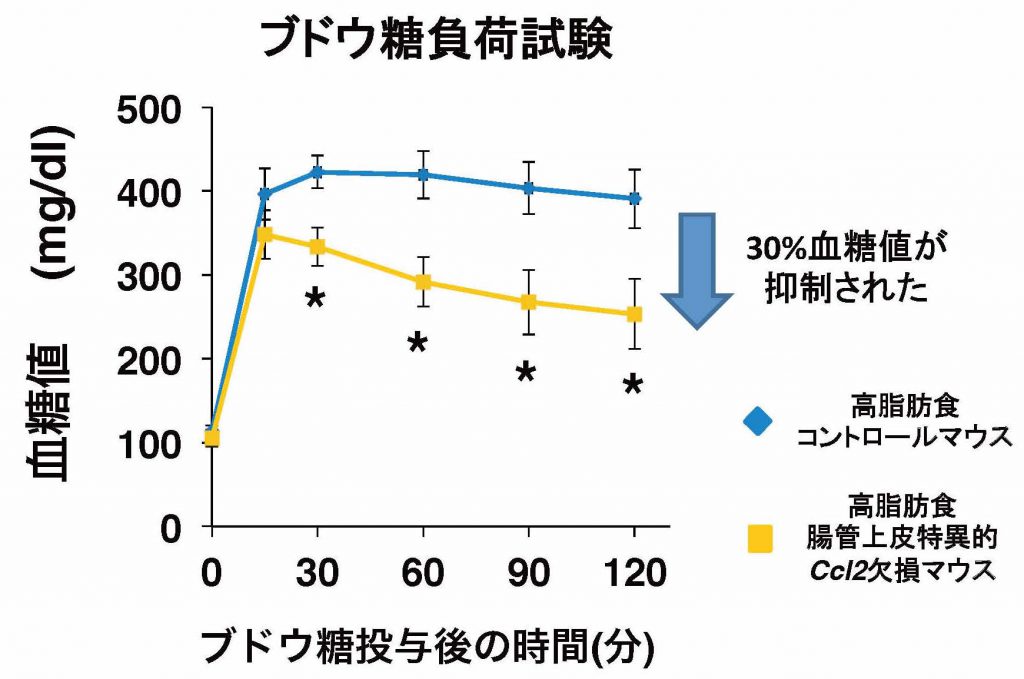
さらに、興味深いことに、Vil-Ccl2KOでは、大腸だけではなく脂肪組織でも脂肪細胞が肥大化しているにも関わらず、慢性炎症が低下しました。
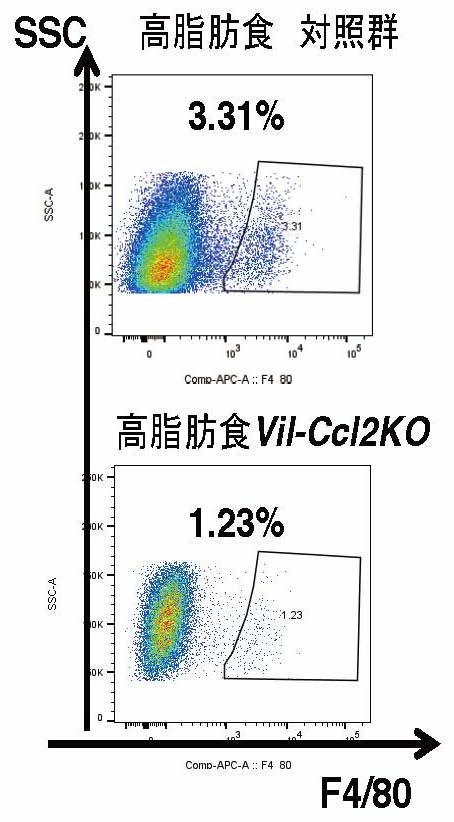
以上のことは、大腸の慢性炎症、すなわち炎症性マクロファージを制御すれば、インスリン作用に重要な末梢の臓器のインスリン感受性をコントロールできることを証明したことになります。
高脂肪食負荷がインスリン抵抗性を引き起こすメカニズム
それでは、高脂肪食負荷による大腸の炎症性マクロファージによる慢性炎症がどのようにインスリン抵抗性を起こし、糖尿病につながるのでしょうか。大きく二つの可能性が考えられます。
ひとつは、大腸の腸管バリアー機能の低下です。前述したように、腸管腔には食物抗原、腸内細菌をはじめとしたさまざまな生体外の異物が存在し、それらが、循環血中に入らないように防御する隔たりが必要であり、それが腸管バリアー機能です。腸管バリア機能は、それに関わる特殊なタンパク質が関係しており、高脂肪食負荷での大腸ではそのうちの一つClaudin1というタンパク質が低下し、腸管腔から物質が循環血中に漏れやすいことがわかりました。特徴的なのは、細菌構成成分の一つであり炎症性サイトカインとともにインスリン抵抗性を引き起こすことが知られているlipopolysaccharide(LPS)の門脈中の濃度が、高脂肪食負荷した対照群マウスでは普通食群に比べ有意に増加し、作製したふたつの遺伝子改変マウスでは、正常化していたことです。
もうひとつは、高脂肪食負荷により大腸のインフラマゾームの活性化が起こることです。近年、高脂肪食による慢性炎症の誘導機序において、炎症誘導シグナルを感知し炎症のシグナルを伝達するために必要なアダプター蛋白としてインフラマゾームが重要であることが認識されるようになりました。高脂肪食負荷4週の大腸においてinflammasomeの活性化を示唆するspeckled patternを呈するASC活性細胞の有意な増加を認めましたが、M-Ccr2KOとVil-Ccl2KOマウス大腸においては、それらが有意に抑制されています。また、インフラマゾームに制御される代表的な炎症性サイトカインとしてIL1βとIL18が知られていますが、M-Ccr2KO、Vil-Ccl2KO大腸では、コントロールと比較してそれらの炎症性サイトカインの発現が低下しており、それに伴い門脈内IL-18濃度が有意に低下し、インスリン抵抗性改善の一因になっている可能性が考えられました。以上の結果から、高脂肪食負荷大腸においては、inflammasomeの活性化が大腸の腸管上皮Ccl2-マクロファージCcr2経路に制御を受ける事が示唆されました。
今後の展望
本研究の結果から、高脂肪食負荷誘導性の肥満マウスにおいて、腸管のマクロファージが脂肪組織の慢性炎症を”リモートコントロール”し、全身のインスリン抵抗性を調節することが明らかになりました。
また、ケモカインの産生を抑制することが、肥満による2型糖尿病発症を抑える戦略になりうると考えられました。高脂肪食負荷モデルマウスにおいては、腸管上皮Ccl2が重要になることが分かったのですが、他にも高脂肪食負荷した腸管上皮細胞で発現が増加するケモカインは存在しており、今後のさらなる検討が必要です。また、腸管マクロファージには骨髄単球由来の炎症性マクロファージだけでなく、元々組織に存在して腸管の免疫寛容に寄与している常在性マクロファージがあり、他にも、腸管樹状細胞、自然リンパ球、抗体産生細胞などさまざまな種類の腸管免疫細胞が存在しており、高脂肪食や腸内細菌叢の変化を受けて、どのように抗原情報が獲得免疫を伝達し、インスリン抵抗性に寄与しうるのかも興味深いです。さらに、ヒト特に肥満症患者や糖尿病患者の大腸におけるケモカインの同定、および具体的なケモカイン産生の分子メカニズムは全く解明されておらず、腸管上皮からのケモカイン産生・活性を抑制する化合物の同定を行っていく事は、今後の重要な課題です。
この記事を書いた人
- 慶應義塾大学医学部特任准教授。1986年に北海道大学医学部医学科を卒業後、北海道大学薬学部遺伝子有機化学講座研究生、米国国立衛生研究所National Institute of Health, Visiting fellow、コロンビア大学The Naomi Berrie Diabetes Center, Columbia University Medical Center, Postdoctoral research fellow/Assistant professor、旭川医科大学小児科助手、旭川医科大学小児科講師、神戸大学大学院医学系研究科COE上級研究員、慶應義塾大学医学部特別研究准教授を経て、現在に至る




