iPS細胞で脊髄損傷が治る? – 再生医療を実現するための三位一体の治療戦略とは
わが国では年間およそ5千人もの方が脊髄損傷を受傷しており、慢性期脊髄損傷患者さんの人数は延べ20万人以上に達しているといわれます。近年の脊髄損傷に対する集学的医療の進歩によりその平均余命は飛躍的に向上していますが、損傷脊髄そのものを治療する方法はいまだ確立されていません。
人工多能性幹細胞(iPS細胞)技術が開発される以前は、胚性幹細胞(ES細胞)技術を用いた再生医療が期待を集めていました。私が所属する慶應義塾大学医学部脊髄損傷治療研究グループでも、ヒトES細胞由来NS/PCsを小型の霊長類コモンマーモセット損傷脊髄に移植して運動機能の回復を導くことにまでも成功し、臨床応用まであと一歩というところまで来ていました。しかしこの方法では、中絶胎児からの細胞採取または不妊治療における余剰胚からのES細胞樹立を要します。2005年に厚生労働省からこうしたES細胞の利用は倫理的側面が解決するまで延期すべきとの見解が示され、いまだにその問題は継続審議すなわち棚上げされたままの状況です。
2006年に京都大学の山中伸弥教授らはiPS細胞を樹立し報告しました。この技術によって、数種類の遺伝子を導入することで皮膚などの細胞を初期化し、ES細胞と同様の増殖能・分化能を有する多能性幹細胞が倫理的問題なく作出可能となりました。2012年に山中教授がノーベル医学生理学賞を受賞され、2015年に滲出型加齢黄斑変性患者に対する自家iPS細胞由来網膜色素上皮シート移植が理化学研究所主導で行われたのは記憶に新しいところです。脊髄損傷に対するiPS細胞による再生医療の実現化へ向けた慶應義塾大学と京都大学との共同研究も2006年に開始されています。2011年にはかなり臨床に近いモデルとして、ヒトiPS細胞由来神経幹細胞の免疫不全マウス亜急性期損傷モデルへの移植を行い、運動機能回復の促進、運動誘発電位の改善、移植細胞の神経系統の3つの細胞種(ニューロン、オリゴデンドロサイト、アストロサイト)への分化、ドナー細胞とレシピエント細胞間でのシナプス形成などの種々の有効性を示す所見を報告しています。
ただし、その実現化にはなお解決すべき問題が残されています。
1つ目は腫瘍化の問題です。iPS細胞には、危険な株(クローン)が存在し、奇形腫や神経系腫瘍の母地となる知見が報告されているのです。分化させた後の状態ではこうした腫瘍化のリスクはよりコントロールしやすくなりますので、疾患によってはすでにヒトへの応用が開始されているわけですが、脊髄損傷においてはそうはいきません。脊髄というデリケートな組織の内部の細かい構造の中に、周囲へのダメージを最小に保ちながら、分化させ切った特定の細胞を移植し分けることは不可能ですので、ある程度元気で未分化な神経幹細胞の状態でまとめて移植して、脊髄の中で適切に分化し遊走してもらい、その上で移植先の神経細胞とネットワークを形成したり、神経を取り巻く髄鞘を作ってもらったりしなくてはなりません。従って、どのように安全な神経幹細胞を作製してゆくのか、たいへん厳しい基準によるシステム作りがいま進められているところです。
次に、タイムラグの問題があります。患者さん自身の細胞からiPS細胞を樹立し、そこから神経幹細胞を誘導し、さらに培養して移植に十分な細胞数を得るためにはどのくらい時間がかかるでしょうか? 最も順調にいって半年以上、さらに安全性確認も必要です。これでは神経幹細胞移植が有用であることがわかっている亜急性期のうちに移植することはできません。さらには個別に行うための莫大な費用がかかることも考慮しなければなりません。こちらの問題に関しては、各種HLA型に対応できる安全性を確認したiPS細胞ストックを常時蓄える「iPS細胞バンク」の実現化が進められ、iPS細胞由来神経幹細胞移植の臨床応用へ向けた基盤は着々と整えられてきています。
さて前後しましたが、脊髄損傷への神経幹細胞移植には有効な「時間の窓」があることが知られています。例えば、齧歯類のマウスは損傷後9日目で、亜急性期前期に相当します。損傷に伴う炎症反応が強すぎる急性期よりも、少し落ち着いてきた亜急性期の方が効果が得られやすいからで、私たちのグループが世界に先駆けて報告しました。そして、この時間の窓は亜急性期後期~慢性期早期には閉じてしまうということがわかっています。それを超えた慢性期になると、損傷部には移植細胞の働きを物理的に阻害する固い瘢痕組織や、移植細胞が伸ばす軸索の成長を化学的に阻害する軸索伸展阻害因子などが発現し、神経幹細胞移植が効果を発揮しなくなってしまうのです。脊髄損傷患者さんの大多数は受傷後半年以上が経過した慢性期ですので、いかにして再生医療をこのような患者さんに届けるかということは、われわれ脊髄損傷研究に携わる者にとっての大きな課題であります。
こうした中、最近、慢性期脊髄損傷に対する神経幹細胞移植も別の治療法と併用すれば有効性を発揮するとする研究結果が少しずつ報告されてきています。瘢痕組織を溶解するコンドロイチナーゼABC、軸索伸展阻害因子を阻害するセマフォリン3A阻害剤などは、慢性期の損傷部自体の環境を整える点で最も有用と考えられている薬剤の代表例です。また移植細胞を活性化させる神経栄養因子を併用する方法の有効性も報告されています。ただしこれらは開発途上の薬剤であり、患者さんに対してすぐに使用できるような性質のものではないことに留意が必要です。臨床現場で行われているトレッドミル歩行訓練などのリハビリテーション(リハ)治療も多くの患者さんに実施可能な有望な併用療法の候補のひとつであると考えられてきました。リハにより前述の神経栄養因子の組織内部での発現を増加させることができるほか、移植した神経幹細胞由来の神経細胞はある意味無秩序に周辺の神経細胞とネットワークを形成すると考えられますが、適切なリハは必要な神経のつながりのみを強化することができるなどの理由です。ところが、神経幹細胞移植技術が主に確立している動物種はマウスであるのに対して、リハに関しては小さくて耐久性が低く扱いが困難なマウスではなく、大きく温厚で耐久性の高いラットでその手法は主に確立されてきていました。このような背景もあって神経幹細胞移植とリハの技術を兼備する研究グループは世界の中でもごく少数にとどまっており、移植とリハの併用療法の報告は亜急性期を対象とした論文が少数上梓されているのみで慢性期に対するものは皆無でした。
今回私たちは、慢性期脊髄損傷モデルマウスに神経幹細胞移植とトレッドミル歩行リハの併用療法を行い、併用療法群、移植単独群、リハ単独群、対照群の四群でその効果を比較し、併用療法群で対照群と比較して有意な運動機能の回復が観察されることを報告しました。

この中では、神経幹細胞移植による脊髄の伝導性や歩行中枢を活性化させる効果、リハによる運動コントロールへの適切な抑制性を回復させる効果がそれぞれ確認されました。さらに特筆すべきは、併用療法群ではこれらの相加的な効果にとどまらず、ニューロン(神経細胞)へ分化する神経幹細胞の割合の増加、腰部脊髄にある歩行中枢での新生線維やシナプスの増加といった相乗的効果が発揮されることが明らかになりました。
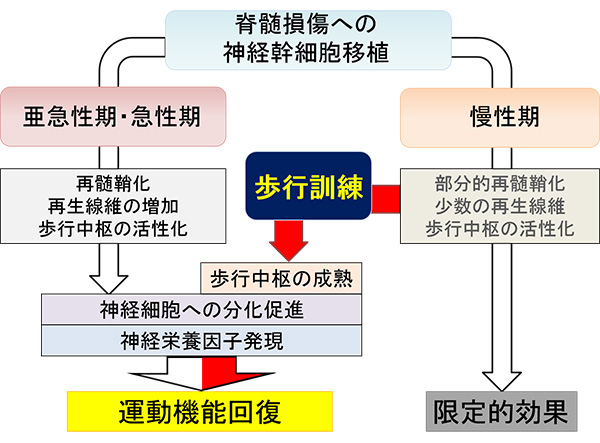
他方、損傷中心部への治療効果は限定的なものに止まっていました。ここで注意が必要なのは、併用療法群とリハ単独群を比べた場合に併用群の方が高い運動機能が得られる傾向が観察されたものの、統計学的には有意な差が検出されなかったことです。これは慢性期にリハを頑張っているのと比較して、追加で神経幹細胞移植を行った際の上積み効果は有意なレベルにまで到達しないということですから、残念ながらまだ慢性期脊髄損傷患者さんへの再生医療の実現化には不十分であると判断せざるを得ません。それほど治療の難しい病態なのです。
最後になりますが、リハとの併用だけでは改善効果が不十分であることがわかった損傷中心部をどう治療したら良いかを考えたとき、これは先述の薬物療法の得意とするところですから、薬物療法、リハビリテーション、そして細胞移植を用いて損傷中心部と歩行中枢の両者にアプローチする、三位一体の治療法が、この問題を解決してくれるのではないかと考えています。慢性期脊髄損傷患者さんへの再生医療への実現へ向け、私たちはさらに研究を深めてゆきたいと考えています。
参考文献
- Iwanami A, Kaneko S, Nakamura M, Kanemura Y, Mori H, Kobayashi S, Yamasaki M, Momoshima S, Ishii H, Ando K, Tanioka Y, Tamaoki N, Nomura T, Toyama Y, Okano H. Transplantation of human neural stem cells for spinal cord injury in primates. J Neurosci Res. 182-190, 2005
- Nori S, Okada Y, Yasuda A, Tsuji O, Takahashi Y, Kobayashi Y, Fujiyoshi K, Koike M, Uchiyama Y, Ikeda E, Toyama Y, Yamanaka S, Nakamura M, Okano H. Grafted human-induced pluripotent stem-cell-derived neurospheres promote motor functional recovery after spinal cord injury in mice. Proc Natl Acad Sci USA. 16825-16830, 2011
- Ogawa Y, Sawamoto K, Miyata T, Miyao S, Watanabe M, Nakamura M, Bregman BS, Koike M, Uchiyama Y, Toyama Y, Okano H. Transplantation of in vitro-expanded fetal neural progenitor cells results in neurogenesis and functional recovery after spinal cord contusion injury in adult rats. J Neurosci Res. 2002 Sep 15;69(6):925-33.
- Tashiro S, Nishimura S, Iwai H, Sugai K, Zhang L, Shinozaki M, Iwanami A, Toyama Y, Liu M, Okano H, Nakamura M. Functional Recovery from Neural Stem/Progenitor Cell Transplantation Combined with Treadmill Training in Mice with Chronic Spinal Cord Injury.Sci Rep. 2016 Aug 3;6:30898. doi: 10.1038/srep30898.
この記事を書いた人

- 医師。リハビリテーション(リハ)科専門医・指導医ほか。平成18年慶應義塾大学医学部卒業。初期研修修了後、慶應義塾大学医学部リハ医学教室入局。月が瀬リハセンターなどへ勤務後、同大学大学院に進学し、生理学岡野栄之教授・整形外科学中村雅也教授、リハ医学里宇明元教授に師事し、脊髄損傷治療研究グループにて研究に取り組む。平成27年博士課程卒業。現在、慶應義塾大学医学部リハ医学教室非常勤講師。専門領域は、脊髄損傷への再生医療実現化へ向けた橋渡し研究(基礎ならびに臨床)、慢性期脳卒中上肢麻痺に対するSeamlessなリハ・アプローチの開発、地域在住高齢者の嚥下障害に関する研究、ハンセン氏病のリハ、災害リハなど。