「ナノ物質の周期表」の誕生 – 幾何学的対称性から生まれた新たな理論モデル
ナノ物質の周期表
原子の物理的・化学的な性質は元素によってさまざまに変化しますが、完全にばらばらなわけではなく、原子番号(原子核に含まれる陽子の数)に従ってある一定の周期で変化することが知られています。この周期に沿って元素を並べたものが「元素周期表」で、1869年にロシアの化学者、ドミトリ・メンデレーエフにより提案されて以来、元素の性質を予測したり、未発見の元素を探索したりするのに大きな役割を果たしてきました。
2016年には、理化学研究所により原子番号113の「ニホニウム」が合成され、日本初の新元素発見として大きなニュースになりました。現在では118種類もの元素が表の中に並び、今もなお新しい元素を発見する試みが続けられています。2019年は、この「元素周期表」の発見から150周年の記念すべき年にあたり、UNESCOにより「国際周期表年(IYPT2019)」として宣言されました。
このように、自然科学の発展に大きく貢献してきた元素周期表ですが、原子よりも大きなスケールの「物質」に、こういった周期表は存在しないのでしょうか? 私たちの身の周りにある物質はすべて、たくさんの原子が集まってできています。もし、物質の周期表を作ることができたら、未知の物質や材料を探索するうえで画期的な指標となるでしょう。
しかしながら、元素に見られるような傾向や法則、周期律といったものは、これまで物質の世界では見出されていませんでした。複数の原子が集まってできている物質は、原子そのものよりも複雑で、いろいろな形・原子の数・元素の種類などの原子にはない要素を持っています。この3つを考えただけでも、元素のように単純に分類することがいかに難しいかがわかります。
しかし最近、我々の研究グループは、コンピューターシミュレーションなどを駆使して物質の性質を予測する新たな理論を開発し、この理論を基に「ナノ物質の周期表」を組み上げることに成功しました。本稿では、この「ナノ物質の周期表」の成り立ちについて、まずは「そもそもなぜ元素の性質に周期律が現れるのか」という話からはじめ、できるだけわかりやすく説明していきたいと思います。
元素の性質はどのように決まるのか?
原子は、正電荷を持つ原子核と負電荷を持つ電子から成り立っていて、原子番号の大きな元素になるほど、原子はよりたくさんの電子を持つようになります。電子は、原子核の周りに広がる「軌道」に、最大で2個収まることができます。軌道にはいろいろな大きさや形があり、どの軌道にいくつの電子が収まるかによって原子が持つエネルギーが決まります。この収まり方を「電子配置」と呼びます。それぞれの元素が持つ性質は「電子配置」に由来し、これが周期律が現れる要因にもなっています。
もう少し詳しく見ていきます。電子が収まる軌道にはそれぞれ名前がつけられていて、軌道の形によってs, p, d, f,……という記号が使われます。s型には1種類、p型には3種類、d型には5種類、f型には7種類の軌道があり、それぞれ特徴的な形をしています。これらの軌道が持つエネルギーには決まった順番があり、ほぼ1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p,……という順番でエネルギーが高くなっていきます。同じタイプの軌道はエネルギーの低い方から順に1, 2, 3……とラベル付けされています。
電子は、エネルギーの低い軌道に入ることを好むので、下の方の軌道から順番に席を埋めて行きます。実は、原子の性質を最も大きく左右するのは、このなかでエネルギーの高い軌道に収まった電子で、特別に「価電子」と呼ばれています。元素の性質は、「どの形の軌道に」「いくつ価電子が入るか」によって決まり、同じ形の軌道に同じ数の価電子が入っていると、同じような性質が現れます。
ここで、先ほどの軌道の順序を見てみると、たとえばp型の軌道が一定の間隔をおいて2p…3p…4p…と何度も現れることがわかります。これが元素の周期律の正体で、この電子配置に従って元素を並べたのが元素周期表なのです。
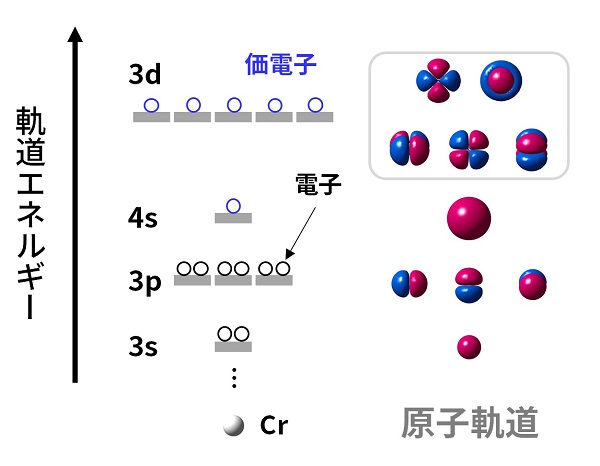
(左)軌道のエネルギーの順番はおおよそ決まっている。それぞれの軌道に最大2個までの電子が収まる。ここでは、エネルギーの高い3d軌道や4s軌道に入っている電子が価電子に当たる。(右)軌道の形。
原子が集まってできた物質
ここで、分子をはじめとしたさまざまな物質がどのように成り立っているのかを見ていきます。物質は、たくさんの原子が結合してできていますが、そこには先ほど述べた「価電子」が密接に関わっています。価電子は、原子の中で高いエネルギーの軌道に入った電子ですが、原子はどうにかしてそのエネルギーを下げようとします。そのひとつの解決策が、価電子を複数の原子のあいだで共有することです。こうすることで、エネルギーの低い新たな軌道が形成されます。原子同士が結合を作るのは、お互いの価電子を共有することでエネルギーを低くしようとした結果なのです。
実は、この原子同士が共有した価電子にこそ、物質の性質を予測するうえで重要なヒントが隠されています。物質の性質も原子の場合と同じように、「軌道の形」と「価電子の数」によって決まります。ここまでくると、原子のように物質の予測も簡単にできそうに感じられますが、そう上手くはいきません。原子のときと比べると、物質の軌道の形も、軌道のエネルギーの順番もずっと複雑です。このことが原因で、物質の性質を予測することは原子より難しいのです。
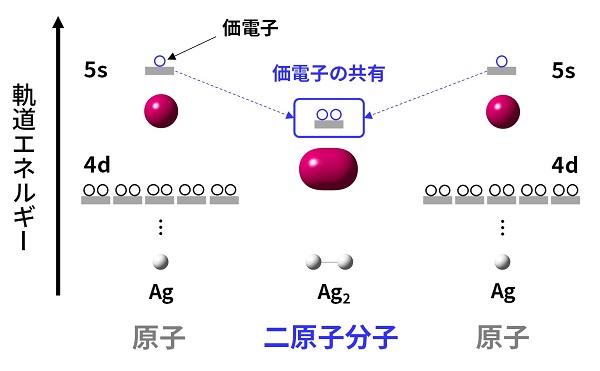
原子同士が価電子を共有することで、エネルギーの低い新たな軌道が形成される。よりたくさんの原子が結合すると、軌道の形やエネルギーの順番が複雑になっていく。
「幾何学的対称性」から物質の性質を予測する
ここまで説明してきたように、物質の軌道の形とエネルギーは原子よりもはるかに複雑で、これをどのように扱うかが大きな課題となっていました。そこで今回、我々の研究グループでは、物質の「幾何学的対称性」に注目してみることにしました。
幾何学的対称性というのは、物質の姿かたちの対称性のことです。たとえば、4個の原子が結合すれば、四角形型の対称性を持つ物質ができあがります。最も高い対称性は原子の持つ球対称ですが、物質は原子が集まってできているので球対称を持つことはできません。そのため、正二十面体型・正八面体型・正四面体型などが、物質が持つことができるもっとも高い対称性になっています。これまで、「物質が持つ価電子の軌道の形は複雑だ」ということが問題になっていましたが、同じ対称性を持つ物質に絞って見たらどのようになるでしょうか。
そこで我々は、同じ対称性を持つ物質の軌道の形や軌道のエネルギーがどのようになっているのかを知るために、コンピューターシミュレーションを利用することにしました。正二十面体型・正八面体型・正四面体型をはじめとした、さまざまな対称性を持つ物質について調べてみると、おもしろいことに物質の中にもある一定の法則があることがわかってきました。
まず、対称性の高い物質が持つ軌道は、原子の軌道の形にとてもよく似ていることがわかります。ここでは、原子のときと同じように、S, P, D, F,……という記号を使って、物質の軌道に名前をつけることができます。注目すべき点は、同じ対称性を持つ物質に絞って見ると、軌道のエネルギーの順番が皆同じになっていることです。
正四面体型の物質を例にとると、原子の数が4個、10個、20個、元素の種類もアンチモン(Sb)、亜鉛(Zn)、金(Au)と異なっているにも関わらず、これらが持つ軌道は互いによく一致していることが見て取れます。
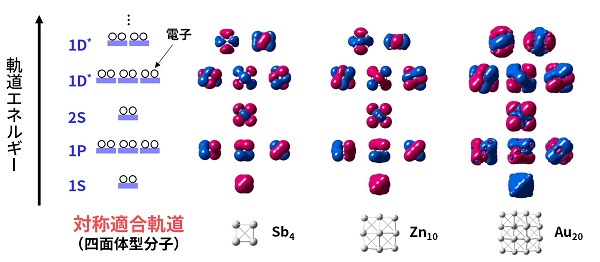
ナノ物質が持つ原子の数や元素の種類が異なっても、対称性が同じであれば、軌道のエネルギーの順番や軌道の形が皆同じになることがわかる。
他の対称性についても見てみると、球形の原子ほど綺麗ではありませんが、物質が持つ対称性ごとに、軌道の形と軌道のエネルギーの順番が決まっていることがわかります。正二十面体は1S, 1P, 1D, 2S, 1F*,……、八面体型の場合は1S, 1P, 1D*, 2S, 1D*, 1F*,……、四面体型の場合は1S, 1P, 2S, 1D*, 1D*, 1F*,……といった具合です(ここで、球対称のときには同じタイプだった軌道が分裂して現れる場合に*を付けています)。
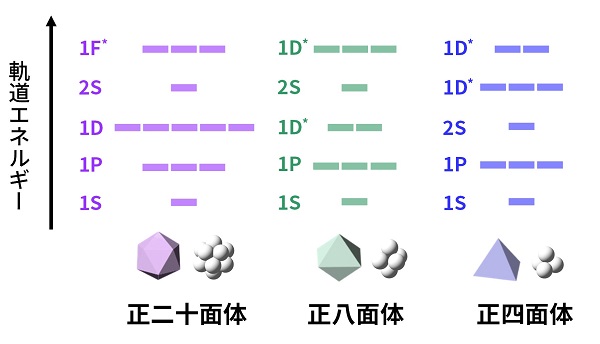
つまりこれは、同じ対称性を持つ物質であれば、原子の場合と同じように物質の性質を予測し、周期律を見出すことができるということを意味しているのです。私たちは、この結果を基にした理論モデルを「対称適合軌道モデル」と名付けました。
ナノ物質の周期表の発見
この「対称適合軌道モデル」を用いることで、原子の場合とほとんど同じように物質の性質を議論できるようになりました。特に対称適合軌道モデルは、原子の数が少ない「ナノ物質」に対して非常によく機能します。
ここでは正四面体型のナノ物質を考えて見ましょう。正四面体型のナノ物質が持つ軌道に、エネルギーの低い方から順に価電子が収まっていくことに注目します。この電子配置に従ってナノ物質を並べていくことで、元素周期表と同じように「族」と「周期」の軸を持った表を組み上げることができます。この表の各マスは、ナノ物質が持つ価電子の数を表しており、元素周期表でいうところの「元素」に相当します。
しかし、おもしろいことにこの表のマスに入るナノ物質はひとつではありません。ナノ物質が持つ価電子の数は、結合している元素の種類や比率によって自在に変えることができるため、一見まったく異なるように見えるナノ物質が同じマスに当てはまるのです。これは、いままでの元素周期表には見られなかった新しい要素で、「種」という軸として付け加えることができます。
また、同じ対称性を持つナノ物質でも、それを作っている原子の数はさまざまです。原子の数が異なるナノ物質それぞれに対して、同じ形の周期表を書き表すことができるので、これを「類」という新しい軸として表現しています。このように、ナノ物質の周期表は「族」「周期」「類」「種」の4つの軸を持つ多次元の周期表として表現でき、このような周期表が、物質が持つ対称性ごとに存在していると考えることができるのです。
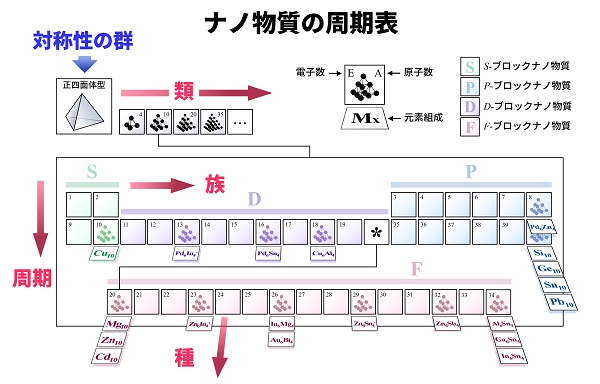
「族」「周期」「類」「種」の4つの次元を持つこのような高次の周期表が、異なる対称性ごとに存在する。これまで発見・合成されてきたさまざまなナノ物質を、本理論モデルによってひとつの表の中に統合することができる。
ここでは詳細を割愛しますが、対称適合軌道モデルは「そのナノ物質が安定に存在できるかどうか」について、ある程度の指標も示してくれます。これまで知られていた化学物質や天然物はすべてこのモデルに当てはまり、安定に存在できる条件を満たしていたのです。そのため、ナノ物質の周期表の中には、さまざまな分野で研究されてきたさまざまなナノ物質を書き込むことができます。
また、この周期表は、未発見の物質や新しい機能材料の探索に応用することもできます。ナノ物質の性質・機能だけでなく、不安定で作ることができないナノ物質を予測することもできるので、「どのような元素を」「どのような組み合わせで」「いくつ集めてくればいいのか」という指針を事前に知っておくことができるのです。
ナノ物質の周期表の今後
対称適合軌道モデルをとおしてナノ物質の電子配置を詳しく理解することで、新しいタイプの周期表を発見することができました。この表に従って、光学的特性・電気的特性・磁気的特性・触媒特性など、多種多様な性質・機能を持ったナノ物質を予測することができます。また、表の中に現れるナノ物質を「大きな元素」とみなせば、ナノ物質を一単位のブロックとして使った、まったく新しい高次の物質の設計や創成ができるかもしれません。次の課題は、こうしたシミュレーション上のナノ物質を実際に合成・実証し、この表に当てはまるナノ物質のライブラリを築いていくことになります。
参考文献
Takamasa Tsukamoto, Naoki Haruta, Tetsuya Kambe, Akiyoshi Kuzume, Kimihisa Yamamoto, “Periodicity of molecular clusters based on symmetry-adapted orbital model”, Nature Communications 10, 3727 (2019).
この記事を書いた人

-
塚本 孝政(写真左)
東京工業大学科学技術創成研究院化学生命科学研究所助教
2015年、首都大学東京都市環境科学研究科博士後期課程修了。博士(工学)。マイアミ大学化学科訪問研究員、東京大学大学院理学系研究科博士研究員、東京工業大学科学技術創成研究院研究員、同特任助教を経て、2019年より現職。専門は光化学、錯体化学、人工光合成、機能性色素、粘土鉱物、有機-無機複合体、ナノシート、デンドリマー、クラスター化学。
春田 直毅(写真中央)
京都大学福井謙一記念研究センター特定助教
2016年、京都大学大学院工学研究科博士後期課程修了。博士(工学)。東京工業大学科学技術創成研究院研究員、同特任助教を経て、2019年より現職。専門は理論化学、量子化学、振電相互作用、ヤーン・テラー効果、群論の応用。
山元 公寿(写真右)
東京工業大学科学技術創成研究院化学生命科学研究所教授
1990年、早稲田大学大学院理工学研究科博士課程修了。工学博士。早稲田大学理工学部助手、早稲田大学理工学総合研究センター助教授、慶應義塾大学理工学部助教授、慶應義塾大学理工学部教授、東京工業大学資源化学研究所教授を経て、2016年より現職。専門は高分子錯体科学、機能材料化学。
この投稿者の最近の記事
 研究成果2019年10月28日「ナノ物質の周期表」の誕生 – 幾何学的対称性から生まれた新たな理論モデル
研究成果2019年10月28日「ナノ物質の周期表」の誕生 – 幾何学的対称性から生まれた新たな理論モデル