副作用の個人差を動物で再現 – HLA導入マウスの開発
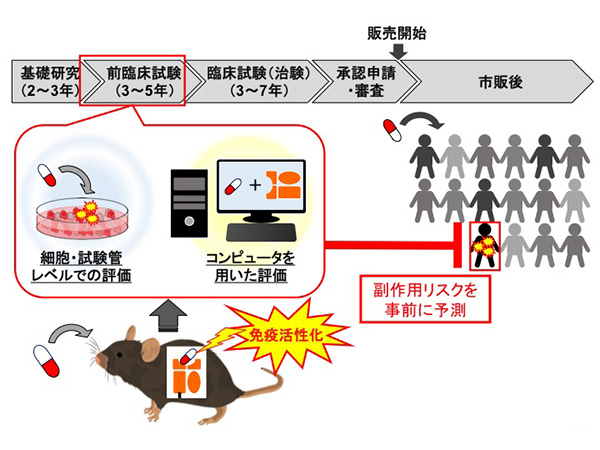
医薬品による副作用には、ある特定の体質(遺伝子)・環境により現れる個人差が関係すると考えられており、なかには死亡例も報告されています。これらの可能性を医薬品の開発段階で見出すことは極めて困難で、市販後、臨床で広く使用されて初めて明らかとなることが大きな問題となっています。これまで多くの研究者がさまざまな動物モデルを用いた検討を試みてきましたが、成功した例は未だかつてありませんでした。そこで私たちは、特定のヒト白血球抗原(HLA)を遺伝子導入したモデルマウスを作製し、HLAが発症に関わる「副作用の個人差」の再現に向けた試みを行いました。
医薬品による副作用の個人差とHLAとの関連
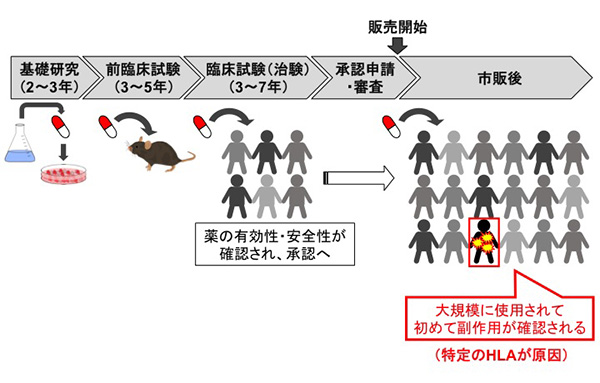
医薬品の副作用のなかでも特異体質性の副作用は特に予測が難しく、投与量を上げたり、投与期間を延ばしたりしたとしても動物で再現することは困難です。そのため、危険性を見いだせないまま臨床試験に進み、また、頻度も稀であるため、限られた人数での試験では目立った副作用として捉えられないことも十分考えられます。最終的には、市販後に大規模に使われて初めてその副作用が明るみになることが多いのが現状です。
近年、特異体質性副作用のなかでも特にHLAの関わるものがいくつかあることがわかってきました。実験動物は当然HLAを持たないため、薬の投与量を上げても意味のある毒性として観察されないことがあります。また、HLAは臓器移植の際の適合性チェックにも使われることからわかるように、個人差が非常に大きく、副作用と関連するHLA型を持った人が臨床試験に十分に含まれている可能性は高くありません。現在の臨床試験では、HLAの型を網羅するような被験者の集め方をしていないので当然です。
自己と非自己を区別するために重要なHLA
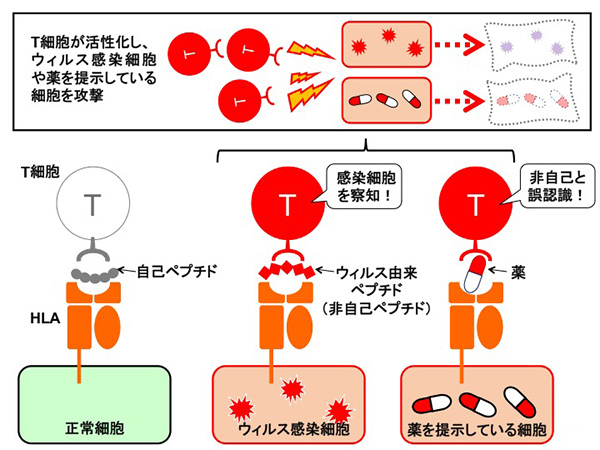
HLAは基本的に全身の細胞に発現しています。通常は自分自身のタンパク質を分解したペプチド断片をT細胞に提示しています。この断片をT細胞が自己ペプチドと判断すれば殺されることはありません。一方、非自己ペプチドを提示し、これがT細胞に捉えられるとその細胞は殺されてしまいます。たとえば、ウィルス感染した細胞の中では、ウィルス由来のタンパク質が産生されますが、これを分解する過程で生じたペプチド断片は非自己の産物です。ウィルス感染細胞はSOS信号のように非自己ペプチドをT細胞に提示し、T細胞がこれを目印に当該感染細胞を殺すことで他に感染拡大することを防いでいるとも言えます。
特定のHLAを持つ人で薬物による副作用が起こる仕組み
HLAにはペプチド断片が提示されることが一般的ですが、稀に薬物そのもの、あるいは薬物と結合したペプチドが提示されることもあることが最近わかってきました。このとき、T細胞は非自己ペプチドを提示しているように捉え、それを提示している細胞をウィルス感染細胞と同じように殺します。よって、薬そのもの、あるいは薬と結合したペプチドを提示しやすいHLAを生まれつき持っている人は、その薬を飲んだときに自己の細胞が傷害を受けることから、副作用を発症するリスクが高くなります。
では、事前にHLA検査をして、特定のHLA型を持つ人にその薬を飲まなければよいのでは? と誰でも思うことでしょう。しかし、実際にはそう話はうまくはいきません。医薬品として売り出されてすぐの段階では、その薬の副作用と関連するHLA型が何かそもそもわかっていないからです。多くの場合、医薬品の市販後に多くの患者に使用し、その結果副作用の現れた人、現れなかった人の遺伝子情報を広く解析して初めて明らかとなるのです。逆に言うと、現在の医薬品の開発プロセスでは、HLAと関連した副作用発現の可能性は全く分からないまま認可され、そのリスクは市販後に多くの患者に使用されて初めて検証されていると言っても過言ではありません。
HLAを導入したマウスを作製して人で起こる薬物副作用を再現する
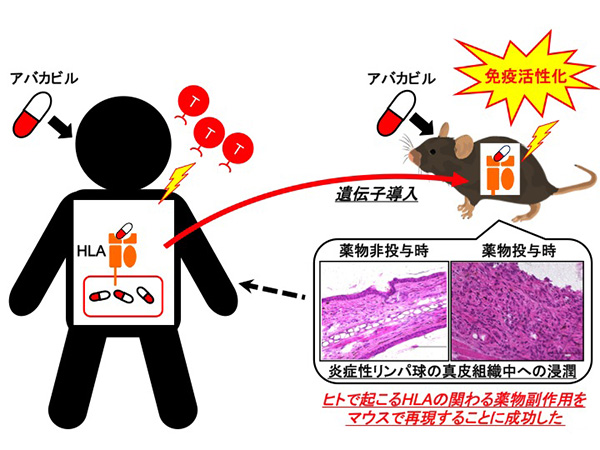
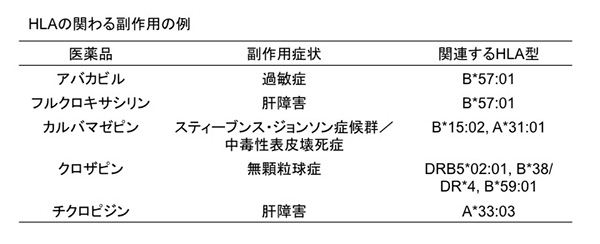
私たちは、HLAの関連する副作用を臨床試験開始前に把握するためにもっとも足りていないのは、「HLA+薬物→副作用発症」のあいだにあるメカニズムの理解だと考えています。メカニズムの理解には、適切な動物モデルが必要と考え、今回HLA型の中でB*57:01遺伝子を導入したマウスを作製しました。HLA-B*57:01はHIVの治療薬であるアバカビルを服用したときの過敏症や、抗生物質であるフルクロキサシリンを服用したときの肝障害と関連することが過去に示されています。HLAを導入した動物モデルはこれまでにいくつか報告されていますが、関節リウマチや1型糖尿病などの自己免疫疾患のモデルであり、薬物副作用の個人差を再現したものはありませんでした。
今回作製したHLA導入マウスでは、アバカビルを皮膚に塗布することでCD8陽性のT細胞が特異的に増殖して活性化することが確認されました。この特徴は、HLA-B*57:01陽性のアバカビル過敏症患者で見られる現象と一致しており、HLAの関わる薬物副作用をマウスで再現した例として初めての報告になります。
詳細は省きますが、HLA-B*57:01をマウス体内で機能させるためにHLAの一部をマウスのものに置換する(キメラHLAと我々は呼んでいます)、ヒトの遺伝子であるHLAをマウス細胞内で安定に発現させるために同時に補助遺伝子を導入するなど、我々が作出したマウスにはいくつかの細工が施されています。キメラHLAがアバカビルを特異的に提示していること、さらにはアバカビルに反応してCD8陽性のT細胞が特異的に活性化されていることなどから、ここで施した細工は有効に働いたと考えられます。
HLAを導入したモデルマウスの有用性
医薬品による副作用の発現と関連が知られているHLAを持っていても必ずしも副作用を発症するわけではありません。たとえば、HLA-B*57:01を持っていても、アバカビルによる過敏症は2人に1人しか起こりません。フルクロキサシリンに関しては、HLA-B*57:01を持っていても1000人に1人しか肝障害を発症しません。つまり、特定のHLA型を持っていることはたくさんあるリスク要因のひとつに過ぎず、副作用が発症するためには、未だ明らかとされていない他のリスク要因も必要であると考えられます。
今回作製したモデルマウスは未知のリスク要因の探索にも有用であると期待されます。今回の手法は他のHLA型と薬物の組み合わせにも適用できるので、これらのHLA型を持ったマウスを同様に作製すれば、副作用が動物で本当に再現できるのか、他にどんな要因が必要なのか、など詳細に調べることが可能になるはずです。
今後の展望
HLAの関わる副作用を臨床試験前に予測できるようにすることが最終目標です。すべてのHLA型に対応した動物を作製するということではありません。HLA型の多さを考えると無謀ですし、仮にこれらの動物が揃えられたとして、膨大な医薬品候補化合物に対して評価すること非現実的です。動物を用いた評価を代替できる、より簡便な系が必要と私たちは考えています。そして、今回作製したモデル動物を丁寧に調べることで、そのような系を作るためのヒントが得られるのではないかと期待しています。つまり、HLAの関わる副作用が起こるときに体内で何が起こっているかを詳細に理解し、その本質を細胞レベル、さらには分子レベルにまで落とし込むことができれば、膨大なHLAの組み合わせと医薬品候補化合物の組み合わせの先にある副作用発症リスクを試験管レベルで評価できる試験系、あるいはコンピュータの力を借りて予測できる系が構築できると考えています。
参考文献
Susukida, T. et al. Evaluation of immune-mediated idiosyncratic drug toxicity using chimeric HLA transgenic mice, Arch Toxicol, 2017 (in press)
Illing, P.T. et al. Immune self-reactivity triggered by drug-modified HLA-peptide repertoire, Nature, 486, 554-558, 2012
Usui, T. and Naisbitt, D. J. Human leukocyte antigen and idiosyncratic adverse drug reactions, Drug Metab Pharmacokinet, 32, 21-30, 2017
この記事を書いた人
- 千葉大学大学院薬学研究院
この投稿者の最近の記事
 研究成果2017年12月26日副作用の個人差を動物で再現 – HLA導入マウスの開発
研究成果2017年12月26日副作用の個人差を動物で再現 – HLA導入マウスの開発



