組織の再生には”ほどほど”の炎症が大切! – ゼブラフィッシュを使った研究で明らかに
多細胞の生き物は再生することが基本
地球上に生命が誕生してから長いこと、生命は単細胞のままでした。ところが、10億年近く前のあるとき、多細胞の生命が誕生しました。通常1個の細胞の寿命は短いのですが、たくさんの細胞が集まり、傷害を受けたパーツ=細胞をどんどん新しく取り替えることによって、多細胞の生き物は個体として長い寿命を入手できたわけです。多かれ少なかれ、多細胞の生命は古くなった細胞や傷ついた部分を再生するということを基本として生命を維持しています。これを組織恒常性(ホメオスタシス)と呼びます。
無脊椎動物のなかには、プラナリアやヒドラなどのように、体のごく小さい組織片から全身を再生できる全身再生という特殊能力を持つ生き物もいますが、脊椎動物はこれほどの能力は持っていません。しかし脊椎動物でも、進化の初期に出現した硬骨魚類や、有尾(しっぽのある)両生類であるイモリやウーパールーパー(メキシコサラマンダー)などは、鰭(ひれ)や手足を失っても、元と同じ器官が再び生えてきます。この現象は、近代生物学以前から知られ、長いこと生物学者を魅了してきました。
知ってのとおり、私たち哺乳類は事故や病気で手足を失うと二度と元には戻りません。また手足だけでなく、心筋梗塞で壊死した心臓の組織も、脊椎損傷で傷ついた脊髄神経も、目のレンズや網膜、多くの内臓器官など、ある程度以上に損傷した組織を元どおりに治すことはできません。ところが魚類などは、鰭や手足だけでなく、心臓、脊椎、レンズ、網膜、さらに多くの内臓器官や、果ては脳の一部を切除しても修復できる奇跡のような再生能力を持つことがわかってきました。いまではヒトも魚も驚くほど遺伝子の数やDNA配列が似通っていることがわかっています。魚にできて私たちにできないということがあるでしょうか? もしも私たちがこのような能力を手にいれることができれば、これまで想像もできなかったような医療や未来が開けてくるかもしれません。いま、生き物が元々持っている再生する能力の仕組みを解明しようと、世界中で多くの研究者が知恵を絞って研究をしています。
ゼブラフィッシュモデルを使った再生研究
ゼブラフィッシュは有用なモデル生物として、20年くらい前から、発生や器官の形成、病気の発症メカニズムなど、あらゆる方向から世界中の研究者が研究しています。最近は組織再生研究にも使われはじめ、これまで100年以上も研究の方法がなかった組織再生の仕組みも次第に解明が進み始めています。私たちは、ゼブラフィッシュを使って組織再生の研究を行っていますが、特に発生直後の個体を使った独自の系で研究を進めてきました。この方法は、組織が再生する過程を分子遺伝学的な手法で調べることや、ある遺伝子が機能を失った致死性のミュータント(変異体)でも、個体が死亡する前に再生の過程を調べることができるなどの利点があります。ゼブラフィッシュでは、膨大な数のミュータントが作製、保存されており、これらを利用して再生に影響するような遺伝子を調べることもできます。
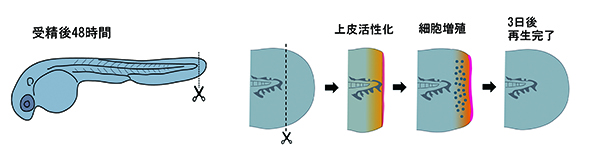
過度の炎症が再生を妨げる
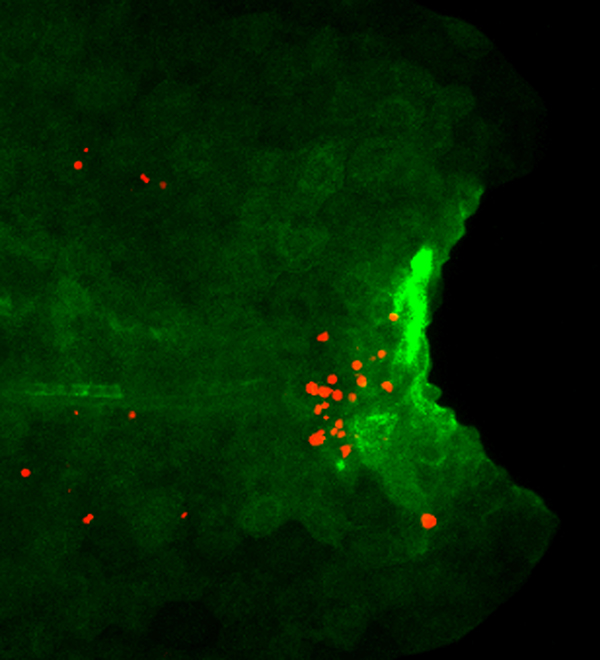
私たちは、ある種のミュータントでは再生するはずの細胞が細胞死を起こして再生できないことを発見しました。それらのミュータントは、血液や免疫細胞(造血系細胞)がほとんど分化しないミュータントでした。つまり、変異した遺伝子の機能が再生に必要なわけではなく、造血系細胞が再生に必要なことがわかってきました。特に造血系細胞のなかでもどの細胞が大事なのか調べると、マクロファージという、死んだ細胞や侵入した細菌などの異物を捕食して消化する白血球の一種の細胞が再生で大切な役割をすることがわかってきました。
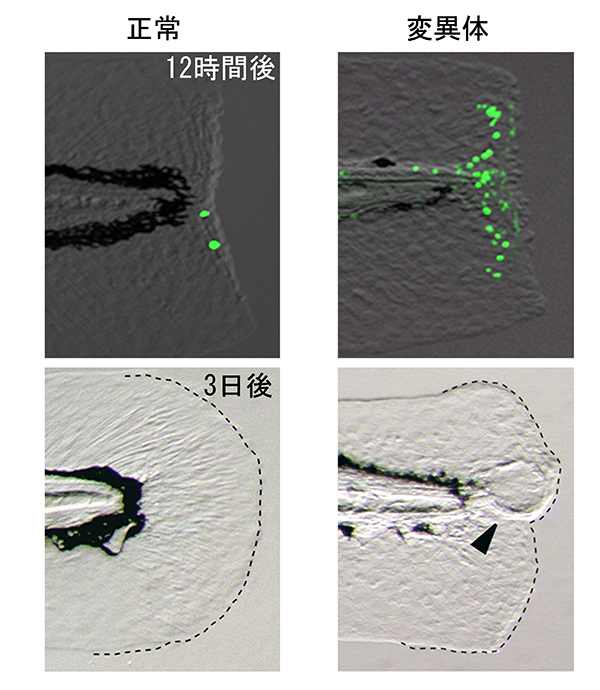
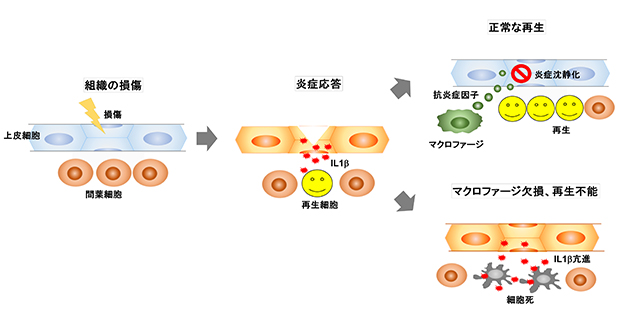
ではなぜマクロファージがないと、再生する細胞が細胞死を起こしやすいのでしょうか? ミュータントで発現が変動する遺伝子を調べてみると、インターロイキン(IL)1βなどの炎症分子の発現が傷害組織で増えていることが明らかになりました。IL1βは、サイトカインと呼ばれる生理活性タンパク質の一種で、炎症反応に深く関与し、炎症性サトカインと呼ばれます。これまでは、マクロファージが壊れた細胞の破片や細菌を取り除くとともに、IL1βを産生して傷口で炎症を起こすと考えられてきました。しかし今回の私たちの研究で、IL1βは主に傷を受けた部分の表皮細胞が作り、マクロファージがいないときには強い炎症が持続して起こることがわかりました。つまり、マクロファージは、いままで考えられてきたように炎症を促進するのではなく、逆に炎症を短時間で収束させる役割を果たすことが示されました。通常はマクロファージによって炎症が短時間で抑制され、細胞が細胞死を免れて再生が進んでいきますが、マクロファージのいないミュータントではIL1βによる炎症が過剰に起こり、再生する予定の細胞が死んでしまって再生できなかったわけです。
炎症は悪いことではない!
一般に炎症と聞くとあまりいいイメージがしないことが多く、実際に私たちが示したように、過度の炎症は細胞死を誘導して再生を妨げます。では、炎症なんて不要でそもそもないほうがいいのでしょうか? ところが、IL1βの作用や炎症を最初から抑えてみると、再生とともに活性化される遺伝子の発現が起こらなくなってしまい、やはり組織の再生は正常には進まないことがわかりました。つまり、IL1βの作用や炎症は再生にとって必要のないもの、悪いものではなく、傷害によって起こる一過的な炎症自体は、組織再生を開始するスイッチとしても働いていたわけです。私たちがこの数年かかって調べてきた再生できないゼブラフィッシュミュータントの研究から、組織再生において炎症が果たす諸刃の剣と言うべき役割が見えてきました。
おわりに
魚類はさまざまな組織を再生できる驚異的な能力を持ちます。この再生の過程を解き明かすことによって、私たち人間のように、あまり再生が得意でない生物でも驚異的な再生能力を発揮できる可能性があります。今回の研究により、傷害を受けた組織がIL1βを産生して炎症を起こすこと、これをマクロファージが抑制して「ほどほど」のレベルに制御することが、組織再生が起こるために重要なことがわかってきました。今後、哺乳類など再生できない組織における炎症応答を調べることや、マクロファージの産生する抗炎症因子の解明などによって、ヒトの組織再生能力を増進する方法や薬の開発に繋がることも期待されます。
参考文献
Hasegawa T, Hall CJ, Crosier PS, Abe G, Kawakami K, Kudo A, Kawakami A. Transient inflammatory response mediated by interleukin-1β is required for proper regeneration in zebrafish fin fold. eLife 10.7554/eLife.22716. 2017.
Shibata E, Yokota Y, Horita N, Kudo A, Abe G, Kawakami K and Kawakami A. Fgf signalling controls diverse aspects of fin regeneration. Development 143, 2920-2929. 2016.
Hasegawa T, Nakajima T, Ishida T, Kudo A and Kawakami A. A diffusible signal derived from hematopoietic cells supports the survival and proliferation of regenerative cells during zebrafish fin fold regeneration. Developmental Biology 399, 80–90. 2015.
この記事を書いた人
- 東京工業大学生命理工学院准教授。博士(理学)。専門はゼブラフィッシュをモデルとした再生生物学、発生遺伝学。広島県出身。京都大学理学部を卒業後、1990年、名古屋大学大学院理学研究科修了。日本学術振興会特別研究員、名古屋大学助手を経て、1997年より、ニューヨーク大学スカボール生物分子医学研究所でゼブラフィッシュモデルを使った研究を始めました。その後、国立遺伝学研究所、東京大学理学系研究科助手を経て、2005年より現職。組織の恒常性(ホメオスタシス)や再生の起こる仕組みの研究を進めています。




